Biblioteca Istituto Zooprofilattico Sperimentale dell'Umbria e delle Marche
Sanità Pubblica Veterinaria: Numero 107, Aprile 2018 [http://www.spvet.it/] ISSN 1592-1581
Documento reperibile all'indirizzo: http://spvet.it/indice-spv.html#677
Isolamento di muffe ambientali in Chelonidi affetti da malattia cutanea: descrizione di due casi
Detection of environmental molds from Chelonians affected by skin disease: two case reports
Elisa Sgariglia1, Andrea Bassani2, Deborah Cruciani1, Cristina Pesca1, Simone Rota3, Andrea Valentini1, Silvia Crotti1, Francesco Agnetti1
1 Istituto Zooprofilattico Sperimentale dell'Umbria e delle Marche "Togo Rosati", Perugia
2 Clinica Veterinaria Aniene, Roma
3 Veterinario freelance, Roma
Abstract. As with other reptiles, chelonians may suffer from mycoses involving the skin, the scale armor and the carapace often attributable to environmental opportunistic molds (gen. Aspergillus, Cephalosporium, Fusarium, Paecilomyces, Penicillium). In addition, skin mycoses due to yeast (i.e. gen. Candida, Chrysosporium, Geotrichum) as well as the presence of potentially pathogenic yeast, at the level of the respiratory and digestive mucous membranes of healthy reptiles have been recently described.
In this context, two case reports about tortoise and turtle skin lesions potentially attributable to fungi are described: Fusarium (F.) oxysporum and Simplicillium sp., respectively, have been isolated and consequently confirmed with PCR analysis and histological examination. The susceptibility to antifungal drugs of the two molds has been evaluated by the minimum inhibitory concentration method (MIC) using YO10 plates (Sensititre®). F. oxysporum showed susceptibility only to voriconazole, while Simplicillium sp. to voriconazole, posaconazole, micafungin and caspofungin. The fungal species described in the two clinical cases, both of which from environmental origin, do not suggest that they have acted as primary pathogens in the chelonian's dermatological pictures; on the other hand it is known that some fungi are primary pathogenic agents in mammals (including human), but it is still unclear if they are also in reptiles. However, the two described case reports contribute to define reptiles as carriers of potentially pathogenic fungi; it also could be useful to continue the epidemiological investigations in this field in order to better detect fungal agents in the "non-conventional" pets medicine
Riassunto. I chelonidi, come altri rettili, possono essere affetti da micosi cutanee che interessano il carapace e/o il piastrone, spesso attribuibili a muffe opportunistiche ambientali (genere Aspergillus, Cephalosporium, Fusarium, Paecilomyces, Penicillium). Recentemente è stata anche descritta la presenza di lieviti potenzialmente patogeni, quali Candida, Chrysosporium, e Geotrichum nell'apparato respiratorio e digerente di rettili clinicamente sani.
Vengono qui descritti due casi clinici di lesioni cutanee in una tartaruga terrestre ed in una acquatica, rispettivamente riconducibili alle muffe Fusarium (F.) oxysporum e Simplicillium sp. L'isolamento di tali miceti è stato confermato mediante PCR ed esame istologico. La sensibilità ai farmaci antimicotici dei due ceppi fungini è stata valutata mediante il metodo della minima concentrazione inibente (MIC) utilizzando piastre YO10 (Sensititre®). F. oxysporum ha mostrato sensibilità solo nei confronti di voriconazolo, mentre Simplicillium sp. nei confronti di voriconazolo, posaconazolo, micafungina e caspofungina. Le due specie descritte, entrambe di origine ambientale, non consentono di riconoscerle come agenti patogeni primari dei quadri clinici osservati; tuttavia è noto che alcuni miceti sono agenti patogeni primari nei mammiferi (uomo compreso), ma è ancora poco chiaro se lo siano anche nei rettili. Comunque, i due casi clinici descritti contribuiscono a definire i rettili come potenziali portatori di funghi patogeni; sarebbe utile continuare le indagini epidemiologiche in questo campo al fine di acquisire maggiori conoscenze degli agenti fungini nella medicina degli animali domestici "non convenzionali"
Introduzione
Allo stato attuale, rettili quali i chelonidi e altre specie cosiddette non convenzionali sono estremamente diffuse in ambito domestico quanto i classici pets; pertanto, anche gli aspetti connessi alla loro salute hanno acquisito maggiore attenzione. Come avviene per altri ospiti, anche i rettili possono rappresentare un habitat favorevole alla crescita di patogeni (primari e/o secondari), pertanto, coloro che hanno a che fare con questi animali (proprietari, allevatori, veterinari ed altri) dovrebbero approfondire le loro conoscenze, non solo nell'ambito nutrizionale e/o di allevamento ma anche in quello sanitario.
Relativamente ai miceti patogeni, i chelonidi possono essere colpiti da patologie fungine che coinvolgono cute, carapace e/o scaglie. Tali problematiche cutanee sembrano essere correlate ad un cattivo management, con particolare riferimento alle temperature e all'umidità (Hatt, 2010) e generalmente attribuibili all'intervento di muffe ambientali opportuniste (gen. Aspergillus, Cephalosporium, Fusarium, Paecilomyces, Penicillium) (Agnetti et al., 2011).
Oltre alle muffe, sono state recentemente descritte anche micosi cutanee causate da lieviti (gen. Candida, Chrysosporium, Geotrichum), come pure sono stati isolati lieviti potenzialmente patogeni dalle membrane dell'apparato respiratorio e digerente di rettili clinicamente sani (Agnetti et al., 2012; Agnetti et al., 2011).
In questo lavoro, gli autori descrivono due casi clinici di micosi cutanea in una tartaruga di terra e in una tartaruga d'acqua dolce, causate rispettivamente dalle muffe Fusarium oxysporum e Simplicillium sp.
Materiali e metodi
Caso clinico 1. Una tartaruga di terra (Testudo hermanni) di 5 anni è stata sottoposta a visita veterinaria per la presenza di aree di desquamazione profonde di colore biancastro a livello di carapace (Figura 1) e piastrone (Figura 2), persistenti da circa due mesi e comparse in tardo inverno-inizio primavera.

Figura 1. Caso clinico n. 1:
Testudo hermanni
Figure 1. Clinical case n. 1:
Testudo hermanni

Figura 2. Caso clinico n. 1: Esemplari di
Testudo hermanni
Figure 2. Clinical case n. 1:
Testudo hermanni specimens
In sede di visita è stato riferito che l'animale vive all'esterno, in un giardino privato, con altri esemplari di età differente presentanti le stesse lesioni cutanee, che l'appetito è sempre stato mantenuto e che l'atteggiamento comportamentale è sempre stato nella norma.
Durante l'esame clinico, sono stati raccolti frammenti di placche e sono stati eseguiti tamponi da carapace e piastrone. I campioni sono stati conservati a 4°C fino all'arrivo in laboratorio e successivamente sono stati sottoposti ad esame microbiologico e micologico. Alcuni frammenti di placche del piastrone sono stati fissati in formalina al 4% per l'esame istologico.
Per le indagini batteriologiche, i campioni sono stati seminati in agar sangue, agar MacConkey e agar Mannitolo e, successivamente, sono stati incubati a 25°±1°C per 24-48h. Le colonie cresciute sono state identificate attraverso valutazione macroscopica della morfologia, colorazione di Gram, test dell'ossidasi e test biochimici in micrometodo mediante l'uso di kit commerciali (gallerie API bioMérieux®). Il test di suscettibilità agli antimicrobici è stato eseguito mediante metodo della disco-diffusione su Mueller-Hinton agar, incubato 25°±1°C per 24h, usando un pannello comprendente 7 molecole (amoxicillina 10µg, cloramfenicolo 30µg, colistina solfato 10µg, enrofloxacina 5µg, gentamicina 10µg, tetraciclina 30µg, sulfa-trimethoprim 25µg) in accordo con le linee guida del Clinical Laboratory Standard Institute (CLSI, 2009).
Per l'esame micologico sono stati utilizzati i terreni di coltura Dermasel agar e agar destrosio Sabouraud, al fine di evidenziare la eventuale presenza rispettivamente di dermatofiti e/o di muffe non dermatofitiche. Le piastre sono state incubate a 25°±1°C fino a 5 giorni, con osservazioni quotidiane; in base alle caratteristiche morfologiche, le colonie cresciute sono state identificate a livello di genere e confermate successivamente mediante l'utilizzo di tecniche molecolari (PCR e sequenziamento).
Per le analisi molecolari, si è proceduto con il taglio di un frammento di colonia che è stato poi trasferito in un tubo contenente 200 µL di acqua distillata. Successivamente è stata eseguita l'estrazione del DNA mediante bollitura per 15 minuti. Il DNA ottenuto è stato amplificato usando i primers ITS4 (5'-TCCTCCGCTTATTGATATGC-3') e ITS5 (5'-AGTAAAAGTCGTAACAAGG-3') (Larena et al. 1999). L'amplificazione del DNA è stata allestita in 50 µL di volume totale comprendente: PCR Buffer 1X, 1.5 mM di MgCl2, 0.25 mM di dNTPs, 0.5 µM di ogni primer, 1.25 U di Taq Hot Start (Promega®) e 3 µL di DNA. I prodotti di PCR sono stati analizzati mediante corsa su gel elettroforetico al 2% di agarosio e visualizzato tramite colorante Midori Green Advance DNA stain (NIPPON Genetics®). I prodotti di PCR sono stati purificati usando QIAquick PCR Purification Kit (Qiagen®) e il sequenziamento è stato allestito in entrambe le direzioni con i primers ITS4 e ITS5, attraverso BigDye Teminator v1.1 Cycle Sequencing Kit, in accordo con il manuale di istruzioni; le reazioni sono state separate attraverso un ABI PRISM 310 Genetic Analyzer (Applied Biosystems®). Le sequenze sono state create con BioEdit Sequence Alignment Editor software v 7.0.9.0 e successivamente allineate su Genbank database.
La suscettibilità agli agenti antifungini è stata rilevata mediante il metodo della minima concentrazione inibente (MIC) usando piastre commerciali (Y010, Sensititre ®) dove vengono testati anidulafungina, micafungina, caspofungina, 5-fluorocitosina, posaconazolo, voriconazolo, itraconazolo, fluconazolo e amfotericina B (CLSI, 2012).
Caso clinico 2. Una tartaruga d'acqua dolce (Trachemys scripta scripta) di circa 10 anni di età, acquistata in un pet-store, è stata sottoposta a visita veterinaria per la presenza di lesioni biancastre sul carapace (Figura 3) e sul piastrone, presenti da circa 3 mesi.

Figura 3. Caso clinico 2.
Trachemys scripta di 10 anni, con lesioni biancastre sul carapace
Figure 3. Clinical case n. 2:
Trachemys scripta of 10 years, with whitish lesions on the carapace
Il proprietario ha riferito che il soggetto vive in casa da solo, in una tipica vasca per tartarughe acquatiche, viene alimentato con una dieta commerciale, il suo appetito è sempre stato mantenuto e il suo atteggiamento comportamentale è sempre stato nella norma.
Durante l'esame clinico sono stati raccolti frammenti di carapace e conservati a 4°C fino all'arrivo in laboratorio per essere poi sottoposti ad esame batteriologico e micologico. Le procedure di laboratorio sono state le medesime descritte nel caso clinico 1 ad eccezione dell'esame istologico che in questo caso non è stato possibile eseguire per assenza di consenso da parte del proprietario.
Risultati
Caso clinico 1. Dopo 48 ore di incubazione, accanto alla crescita di batteri contaminanti, è stata osservata la presenza di colonie giallastre, lucide e mucose, costituite da batteri gram-negativi di forma bastoncellare e positivi al test dell'ossidasi. Il test biochimico API 20NE ha fornito una identificazione con probabilità al 99,8% di Pseudomonas fluorescens, il quale è risultato sensibile a enrofloxacina, gentamicina e colistina solfato, e resistente a tutti gli altri antimicrobici testati. Dopo 3-4 giorni di incubazione, all'esame micologico si è osservata la crescita di alcune muffe.
Tra queste, le più rappresentate hanno mostrato micelio aereo cotonoso, colore giallo della superficie e colore arancio-giallastro del fondo (Figura 4); l'osservazione al microscopio ha evidenziavano ife sottili, ialine e settate, con conidiofori conici ovali e microconidi piccoli, ovali, costituiti da 1 a 2 cellule, isolati o raccolti in cluster (Figura 5); non sono stati rilevati macroconidi.
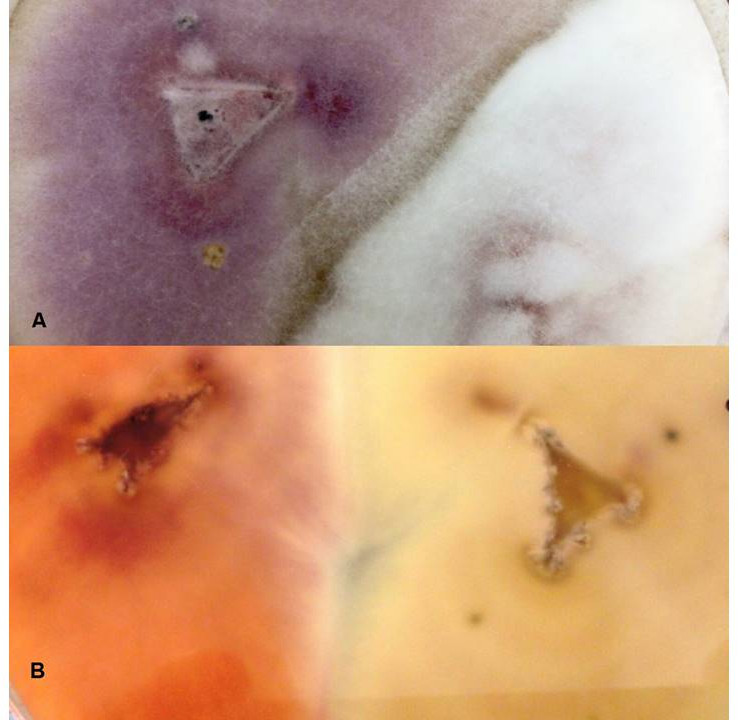
Figura 4. Caso clinico n. 1. Colonie di
Fusarium oxysporum
Figure 4. Clinical case n. 1:
Fusarium oxysporum colonies
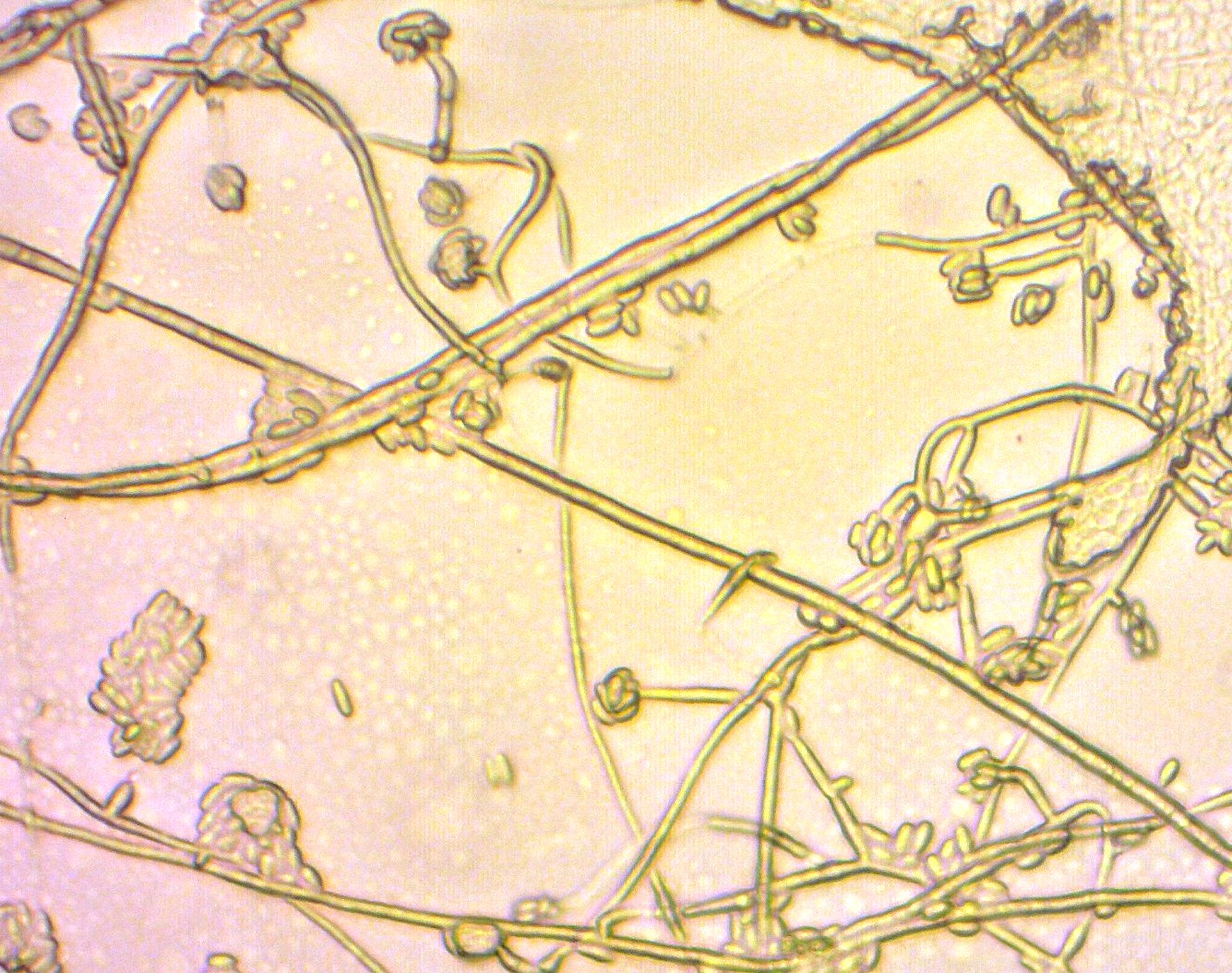
Figura 5. Caso clinico 1: Caratteristiche microscopiche di
F. oxysporum:
ife sottili, ialine e settate, con conidiofori portanti microconidi piccoli e ovali,
a 1-2 cellule, isolate o raggruppati in piccoli clusters (microscopio ottico, 40X)
Figure 5. Clinical case n. 1: Microscopic features of F. oxysporum:
thin, hyaline and septa hyphae, with 1-2 cells conidiophores bearing
small and oval microconidia, isolated or grouped in small clusters
(optical microscope, 40X)
Le caratteristiche macro e micromorfologiche delle suddette colonie hanno permesso di identificarle come Fusarium o Acremonium sp. mentre le tecniche molecolari hanno evidenziato similarità del 99% con Fusarium (F.) oxysporum. Tale muffa è risultata sensibile a voriconazolo ma resistente a tutte le altre molecole testate.
Istologicamente, sono state riscontrati gravi quadri infiammatori su tutti i campioni esaminati. Sono stati rilevati aggregati di granulociti degenerati eterofili con abbondante materiale granulare intensamente eosinofilo. Inoltre, sono state osservate numerose ife di larghezza variabile (5-20µ), scarsamente settate, ad andamento prevalentemente rettilineo, non dicotomiche (Figura 6), presenti in numero elevato in tutti i frammenti esaminati. La diagnosi istologica finale è risultata essere una grave e diffusa dermatite ad eziologia fungina.
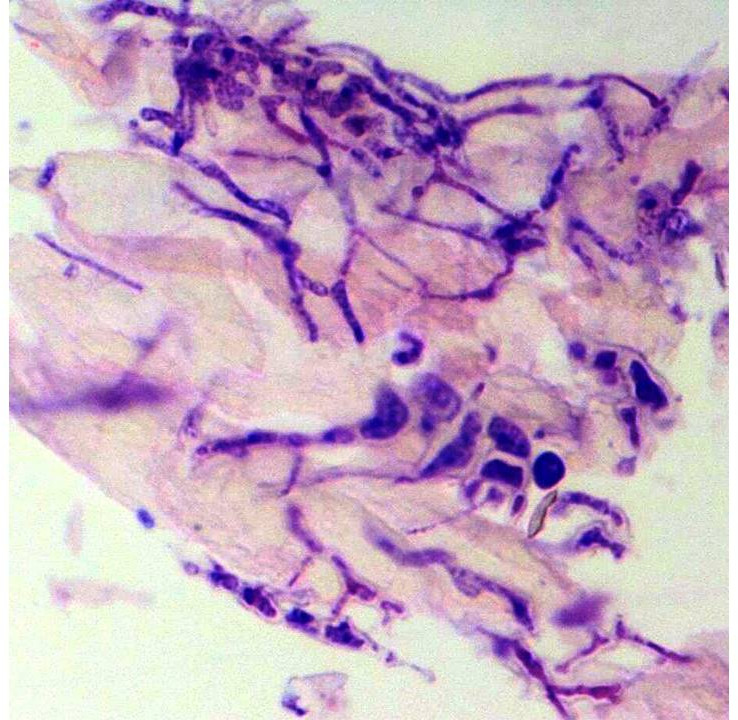
Figura 6. Caso clinico n. 1. Caratteristiche istologiche di un frammento di piastrone, mostrante una diffusa dermatite micotica (Periodic acid-Schiff PAS, 40X)
Figure 6. Clinical case n. 1. Histological features of a shell plate fragment, showing widespread fungal dermatitis (Periodic acid-Schiff PAS, 40X)
Caso clinico 2. L'esame batteriologico è risultato positivo solo per batteri contaminanti, pertanto il test di sensibilità agli antimicrobici non è stato allestito.
All'esame micologico, dopo 4-5 giorni di incubazione si sono evidenziate colonie fungine con micelio cotonoso, superficie biancastra e fondo giallo-brunastro (Figura 7); le stesse, osservate al microscopio, hanno mostrato ife ialine e sottili con conidiofori portatori di microconidi a singole cellule, isolati o raccolti in piccoli clusters (Figura 8); non sono stati rivelati macroconidi. Le caratteristiche macro e micro-morfologiche non hanno consentito l'identificazione della muffa, mentre le tecniche molecolari ha mostrato similarità del 99% con Simplicillium sp. (genere filogeneticamente correlato a Cordiceps sp. ma con caratteristiche morfologiche legate a Lecanicillium sp. (Sung et al., 2007).
Questa muffa si è dimostrata sensibile nei confronti di micafungina, caspofungina, posaconazolo e voriconazolo, mentre è risultata resistente alle altre molecole.
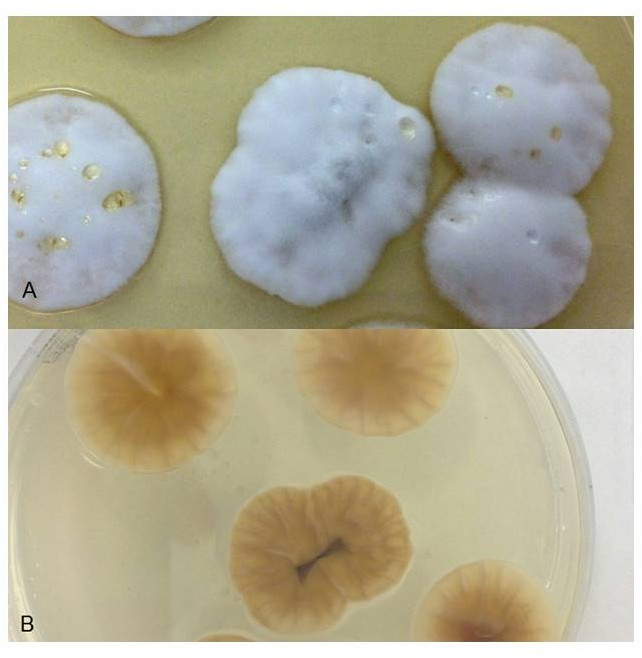
Figura 7. Caso clinico 2. Colonie di
Simplicillium sp. su agar destrosio Sabouraud:
A) superficie biancastra, con micelio cotonoso;
B) fondo giallo-brunastro
Figure 7. Clinical case 2. Colonies of Simplicillium sp. on Sabouraud dextrose agar:
A) whitish surface, with cottony mycelium;
B) yellow-brownish background
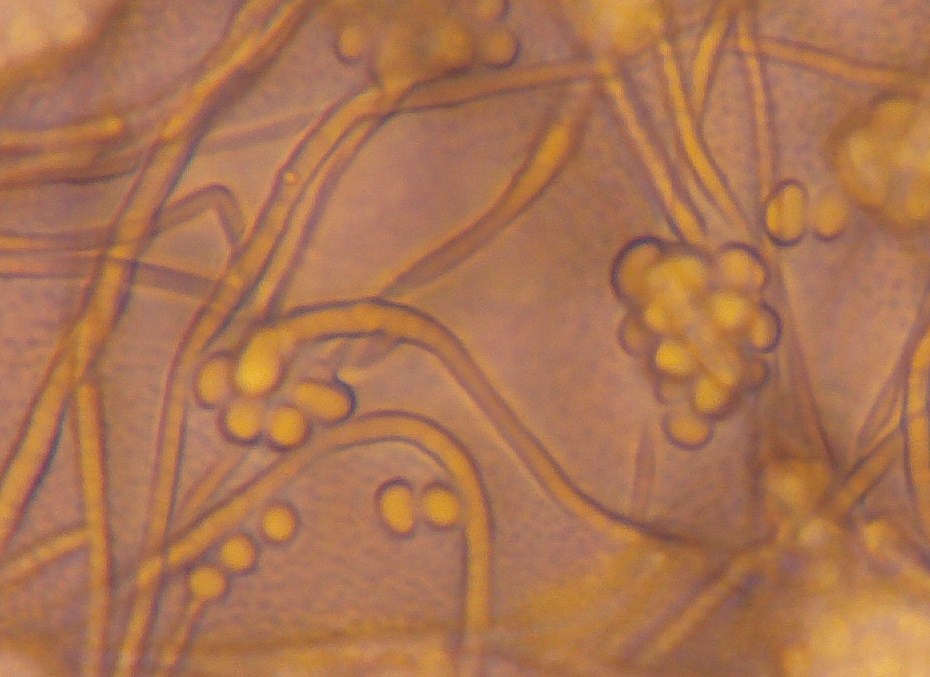
Figura 8. Caso clinico 2. Caratteristiche microscopiche di
Simplicillium sp.:
ife sottili e ialine, con conidiofori portanti clusters di conidi a singole cellule (microscopio ottico, 40X)
Figure 8. Clinical case 2. Clinical case n. 2. Microscopic features of
Simplicillium sp .:
thin hyphae and hyaline, with conidiophores carrying single-cell clusters conidia (optical microscope, 40X
Discussione
Negli ultimi decenni, un numero crescente di rettili, soprattutto tartarughe di acqua dolce e di terra, vengono allevati come animali da compagnia (Nardoni et al., 2012), al pari di altre specie più comuni. Si è stimato che il 3% delle famiglie americane ed europee ospita animali da compagnia "non convenzionali" (Schroter et al., 2004).
In Europa, i chelonidi sono diventati popolari come pets solo negli ultimi anni; in Italia, per esempio, ci sono più di 2 milioni di tartarughe appartenenti principalmente a tre specie di terra: Testudo graeca, T. hermanni e T. marginata (Agnetti et al., 2012).
Come altri animali, anche i chelonidi sono soggetti a diverse malattie infettive, incluse le micosi superficiali, profonde e sistemiche (Nardoni et al., 2012).
Ad esempio, sono descritte infezioni fungine in tartarughe marine da parte di miceti opportunisti che, in determinate circostanze, possono invadere i tessuti superficiali, come pure biotipi fungini in grado di colonizzare il guscio di diverse specie di testuggini, ma in generale i dati su eziologia e clinica relativi alle micosi cutanee nei rettili sono scarsi (Nardoni et al., 2012).
Secondo Frasca et al. (1996), le micosi cutanee dei chelonidi allevati potrebbero essere dovute alla presenza di funghi contaminanti le vasche o i terrari, allo status immunitario dei soggetti, alla presenza di lesioni traumatiche, a trattamenti chirurgici e/o ad altre condizioni di stress associate alla detenzione o al trasporto di questi animali.
Le specie fungine descritte nei due casi clinici, entrambe di origine ambientale, non consentono di affermare che si siano comportate come agenti patogeni primari nei quadri dermatologici evidenziati; d'altro canto è noto che alcuni miceti sono agenti patogeni primari nei mammiferi (uomo compreso), ma è ancora poco chiaro se lo siano anche nei rettili (Mader et al., 2006).
Tuttavia, sono state descritte molte specie fungine (alcune delle quali notoriamente ambientali) isolate da chelonidi, tra cui Aspergillus sp., Candida albicans, Cladosporium sp., Fusarium sp., Microsporum sp., Mucor sp., Paecilomyces sp., Penicillium sp. e Rhodotolura sp. (Lafortune et al., 2005; Schumacher, 2003); molti di questi report non stabiliscono però la correlazione fungo isolato-quadro clinico. In particolare, Fusarium solani è stato isolato in Caretta caretta affetta da ialoifomicosi (Cabanes et al., 1997), mentre F. semitectum in Gopherus berlandieri in corso di patologia necrotizzante del carapace (Rose et al., 2001).
Generalmente, le infezioni causate da Fusarium sp. sono spesso refrattarie alla terapia antifungina, come dimostrato in pazienti granulocitopenici e in modelli animali trattati con amfotericina B, fluconazolo e itraconazolo (Matsumoto et al., 1994).
Di contro, in alcuni casi, la regressione delle lesioni sembra essere stagionale e probabilmente non correlata alla terapia, secondo un processo di auto-remissione (Montali et al., 1981). Nel caso clinico 1 qui descritto, è stata osservata una simile mancata risposta agli antifungini, ad eccezione del voriconazolo, da parte di F. oxysporum; tuttavia, la scomparsa delle lesioni cutanee nel periodo tardo estivo, in assenza di trattamento antimicotico, avvalorano l'ipotesi di una tendenza spontanea della patologia all'auto-remissione.
L'isolamento di P. fluorescens è probabilmente dovuto alla sua presenza ambientale piuttosto che al proprio ruolo patogenetico primario nella comparsa della malattia cutanea.
Considerando invece il caso clinico 2, si potrebbe affermare che questo rappresenta il primo isolamento di Simplicillium sp. da micosi cutanea in un chelonide; infatti, in medicina veterinaria non si conoscono segnalazioni a riguardo. Naturalmente, l'esame istologico sarebbe stato utile per confermare la reale eziologia micotica della malattia.
Simplicillium sp. è stato rilevato nel suolo, in tessuti di piante affette da quadri morbosi, in funghi edibili, in alcuni nematodi e nelle unghie di uomo (Sung et al., 2014). Purtroppo, in medicina veterinaria e umana, le informazioni disponibili relativamente al ruolo patogeno e alla diffusione di Simplicillium sp. sono molto limitate, pertanto risultano necessarie indagini future per comprendere meglio il suo comportamento.
In conclusione, poiché i due casi descritti contribuiscono a definire i rettili come vettori di funghi potenzialmente patogeni (Agnetti et al., 2011), potrebbe essere utile continuare indagini micologiche in queste specie animali e, dal punto di vista tecnico, implementare metodi diagnostici più sensibili e specifici al fine di migliorare il rilevamento di agenti fungini anche nel campo della medicina veterinaria "non convenzionale".
Bibliografia
Agnetti F., Sola D., Scoccia E., Moretta I., Maresca C., Moretti A. (2011). Lieviti nella mucosa orofaringea e cloacale di rettili: considerazioni biologico-sanitarie. [Yeast in the oropharyngeal and cloacal mucosa of reptiles: biological and sanitary considerations]. Summa Animali da Compagnia. [Summa Pets]; 9:23-29.
Agnetti F., Moretta I., Veronesi F., Danesi P., Marenzoni M. L., Deli G., Moretti A. (2012). Presence and identification of yeasts detected by oral and cloacal swabs in captive Chelonia from Central Italy. In: Proc 2012 International Conference on Reptile and Amphibian Medicine; p. 115-117.
Cabanes F. J., Alonso J. M., Castellà G., Alegre F., Domingo M., Pont S. (1997). Cutaneous hyalohyphomycosis caused by Fusarium solani in a loggerhead sea turtle (Caretta caretta L.) Journal of Clinical Microbiology; 35:3343-3345.
Clinical Laboratory Standards Institute. Performance standards for antimicrobial susceptibility testing; Nineteenth Information Supplement CLSI document M100-S19. Wayne, Pa. 2009.
Clinical Laboratory Standards Institute. Reference Method for Broth Dilution Antifungal susceptibility Testing of Yeasts; Fourth Informational Supplement CLSI document M27-S4. Wayne, Pa. 2012.
Frasca S., Dunn J. L., Cooke J. C., Buck J. D. (1996). Mycotic dermatitis in an Atlantic white-sided dolphin, a pygmy sperm whale, and two harbor seals. Journal of the American Veterinary Medical Association; 208: 727-729.
Hatt J. M. (2010). Dermatologische Erkrankungen bei Reptilien. [Dermatological diseases in reptiles]. Schweizer Archiv fur Tierheiilkunde. [Swiss Archive for Veterinary Medicine].; 152(3):123-130.
Lafortune M., Wellehan J. F. X., Terrel S. P., Jacobson E. R., Heard D., Kimbrough J. W. (2005). Shell and systemic hyalohyphomycosis in Fly River turtles Carettochelys insculpta, caused by Paecilomyces lilacinus. Journal of herpetological medicine and surgery; 15: 15-19.
Larena I., Salazar O., Gonza´lez V., Julia´ M.C., Rubio V. (1999). Design of primer for ribosomal DNA internal transcribed spacer with enhanced specificity for ascomycetes. Journal of Biotechnology 1999; 75: 187-19.
Mader D. R. (2006). Stress in captive reptiles. In: Mader D.R. Reptile Medicine and Surgery, Section 3, Anatomy, Physiology and Behaviour. St. Louis (MO): Saunders-Elsevier.
Matsumoto T., Ajello L., Matsuda T., Szaniszlo P. J., Walsh T. J. (1994). Developments in hyalohyphomycosis and phaeohyphomycosis. Journal of medical and veterinary mycology; 32(Suppl 1): 329-349.
Montali R. J., Bush M., Strandberg J. D., Janssen D. L., Boness D. J., Whitla J. C. (1981). Cyclic dermatitis associated with Fusarium sp. infection in pinnipeds. Journal of the American Veterinary Medical Association; 179: 1198-1202.
Nardoni S., Lungonelli P., Papini R., Mugnaini L., Mancianti F. (2012). Shell mycosis in a group of Hermann's tortoise (Testudo hermanni). Veterinary Record; 170:76b.
Rose F. L., Koke J., Koehn R., Smith D. (2001). Identification of the etiological agent for necrotizing scute disease in the Texas tortoise. Journal of Wildlife Diseases; 37: 223-228.
Schroter M., Roggentin P., Hofmann J., Speicher A., Laufs R., Mack D. (2004). Pet-snakes as a reservoir for Salmonella enterica subspecies diarizonae (Serogroup IIIb): a prospective study. Applied Environmental Microbiology; 70:613-615.
Schumacher J. (2003). Fungal diseases of reptiles. Veterinary Clinics of North America: Exotic Animal Practice; 6: 327-335.
Sung G. H., Hywel-Jones N. L., Sung J. M., Luangsa-ard J. J., Shrestha B., Spatafora J. W. (2007). Phylogenetic classification of Cordyceps and the clavicipitaceous fungi. Studies in Mycology; 57: 5-59.
Sung Y. L., Sehee L., Hyun G. K., Jungkwan L. (2014). Entomopathogenecity of Simplicillium lanosoniveum isolated in Korea. Microbiology; 42(4):317-321.

Sgariglia et al, 2018 - Isolamento di muffe ambientali in
Chelonidi affetti da malattia cutanea: descrizione di due casi (SPVet.it 107/2018)






