Documento reperibile all'indirizzo: http://spvet.it/indice-spv.html#696
Studio sull'infestazione da Eustrongylides sp. (Nematoda: Dioctophymatidae)
nei pesci lacustri: risultati della ricerca corrente izsum03/2015
nei pesci lacustri: risultati della ricerca corrente izsum03/2015
Study on the infection by Eustrongylides sp. (Nematoda: Dioctophymatidae)
in lake fish: results of the current research izsum03/2015
in lake fish: results of the current research izsum03/2015
[Ver. 1.0]
Francesco Agnetti(1), Elisa Sgariglia(1), Carmen Maresca(2), Giovanni Lo Vaglio(3), Danilo Serva(4),
Fabrizia Veronesi(5), Claudio Ghittino(1), Maria Letizia Fioravanti(6)
Fabrizia Veronesi(5), Claudio Ghittino(1), Maria Letizia Fioravanti(6)
(1) Istituto Zooprofilattico Sperimentale Umbria e Marche "Togo Rosati", Centro Regionale di Ittiopatologia - Terni
(2) Istituto Zooprofilattico Sperimentale Umbria e Marche "Togo Rosati", Osservatorio Epidemiologico Umbria - Perugia
(3) ASL Umbria 1, Igiene degli alimenti di origine animale, Area del Trasimeno - Perugia
(4) ASL Umbria 2, Igiene della produzione, trasformazione, commercializzazione, conservazione e trasporto degli alimenti di origine animale e loro derivati - Terni
(5) Dip.to di Medicina Veterinaria, Settore Parassitologia e Malattie Parassitarie degli Animali, Università degli Studi di Perugia - Perugia
(6) Dip.to di Scienze Mediche Veterinarie, Scuola di Agraria e Medicina Veterinaria, Alma Mater Studiorum Università di Bologna - Ozzano Emilia (BO)
(2) Istituto Zooprofilattico Sperimentale Umbria e Marche "Togo Rosati", Osservatorio Epidemiologico Umbria - Perugia
(3) ASL Umbria 1, Igiene degli alimenti di origine animale, Area del Trasimeno - Perugia
(4) ASL Umbria 2, Igiene della produzione, trasformazione, commercializzazione, conservazione e trasporto degli alimenti di origine animale e loro derivati - Terni
(5) Dip.to di Medicina Veterinaria, Settore Parassitologia e Malattie Parassitarie degli Animali, Università degli Studi di Perugia - Perugia
(6) Dip.to di Scienze Mediche Veterinarie, Scuola di Agraria e Medicina Veterinaria, Alma Mater Studiorum Università di Bologna - Ozzano Emilia (BO)
Abstract. Eustrongylidosis is a parasitic disease of waterfowl and freshwater fish, caused by the genus Eustrongylides (Nematoda, Dioctophymatidae), also known as Big Red Worm Disease. The recognized valid species, E. tubifex, E. ignotus and E. excisus, can be responsible for large birds' deaths, in particular juveniles of herons and cormorants, which represent the definitive host. The life cycle of the parasite requires as intermediate hosts firstly aquatic oligochaetes and then benthonic fish, in which the 4th stage larvae develops. In the definitive host, adults colonize and reproduce in the thickness of the proventriculus wall. The interest of the scientific community in this parasite has developed in recent years, in addition to its high pathogenicity in birds, especially as a result of some reports of human cases that have highlighted the potential zoonotic role. The presence of large and reddish larvae in fish can represent a health risk for the consumer in case of food preparations at risk such as raw or undercooked fish products. Therefore, it was extremely interesting to study the epidemiology and biology of Eustrongylides sp. in the Umbrian lakes; this in order to be able to understand the mechanisms of diffusion and transmission and to make suitable surveillance actions and/or possible containment measures, also to the light of current legislation regarding the consumption of raw and/or undercooked fish products. In total, 125 samples were examined (105 fish pools weighing around 1kg each, 18 birds and 2 crustaceans). With regard to fish, n. 18 pools were positive at inspection due to the presence of larvae referable to Eustrongylides spp. Within the various fish species sampled, the smelt fish was found to be the most parasitized one. Among the birds, n. 12 out of 18 were positive at necropsy, for the presence of parasitic elements referable to Eustrongylides spp. in the gastro-enteric tract. The most parasitized specimens were found to be cormorant. As regards the fecal samples of waterfowl, no eggs referable to Dioctophymatidae were found in them. With regard to the morphological identification of larvae and adults found in fish and birds, a total of 56 specimens belonging to Eustrongylides spp. were identified, including 5 larvae from fish hosts and 51 adults from avian hosts. On the basis of the morphological characters described and the PCR amplification, the sampled adults were identified as E. excisus. Globally, the data obtained allow us to place the parasite Eustrongylides sp. in the context of Trasimeno Lake (Italy). The presence of the parasite has been demonstrated both in fish and avian samples, in the larval and/or adult stage
Riassunto. L'Eustrongilidosi è una parassitosi degli uccelli ittiofagi e dei pesci dulciacquicoli sostenuta da nematodi appartenenti al genere Eustrongylides (Nematoda, Dioctophymatidae), anche nota nei paesi anglofoni come Big Red Worm Disease. Le specie più conosciute sono E. tubifex, E. ignotus ed E. excisus che possono essere responsabili di grandi morie di uccelli, in particolare di giovanili di aironi e cormorani, che rappresentano l'ospite definitivo.
Il ciclo di vita del parassita richiede quali ospiti intermedi, dapprima anellidi oligocheti acqua-tici e quindi pesci bentofagi (soprattutto Perca fluviatilis), nei quali si sviluppa la larva di quarto stadio infestante. Nell'ospite definitivo (uccelli ittiofagi), gli adulti colonizzano e si ripro-ducono nello spessore della parete del proventricolo.
L'interesse del mondo scientifico e medico-veterinario nei confronti di questo parassita si è sviluppato negli ultimi anni, oltre che alla luce della sua elevata patogenicità negli uccelli ittiofagi, soprattutto a seguito di alcune segnalazioni di casi umani che ne hanno evidenziato il potenziale zoonosico e l'hanno fatta "mediaticamente" avvicinare all'Anisakiasi; negli ospiti ittici, infatti, la presenza di larve di grandi dimensioni e di colore rossastro può rappresentare un rischio sanitario per il consumatore in caso di preparazioni alimentari che non prevedano la cottura o il congelamento del prodotto ittico parassitato.
Alla luce di quanto detto è risultato quindi di estremo interesse poter approfondire l'epidemiologia e la biologia di Eustrongylides spp. nei laghi umbri; ciò al fine di poterne comprendere i meccanismi di diffusione e trasmissione, di confrontarli con quelli di altri agenti parassitari eventualmente presenti nei medesimi contesti lacustri (es. Opisthorchis felineus) e di apportare idonee azioni di sorveglianza e/o eventuali misure contenitive, anche alla luce della normativa vigente in materia di consumo di prodotti ittici crudi e/o poco cotti.
Dal punto di vista pratico, la metodologia messa in atto per lo svolgimento del progetto è stata la seguente:
-Raccolta di campioni di origine ittica: è stata effettuata attraverso degli interventi di prelievo del pescato con cadenza prestabilita, al fine di individuare le specie ittiche più rappresentative (con particolare riguardo a P. fluviatilis) ed inviarle al laboratorio per la ricerca degli stadi larvali del parassita.
-Raccolta di campioni da uccelli acquatici: è stata effettuata attraverso sopralluoghi per individuare aree di nidificazione degli uccelli acquatici e poter così reperire campioni fecali da sottoporre ad esami coproparassitologici, in grado di evidenziare eventuali uova del parassita. Parallelamente, è stata condotta una sorveglianza passiva sugli uccelli acquatici (o eventuali ospiti paratenici quali anfibi e/o rettili) rinvenuti morti nelle zone limitrofe ai bacini lacustri considerati, onde poter ricercare gli adulti di Eustrongylides spp.
-Analisi di laboratorio per la ricerca di stadi larvali in matrici ittiche: i campioni di pesce prelevati sono stati sottoposti ad esame ispettivo e successiva digestione artificiale, per la ricerca di larve di Eustrongylides sp.
-Analisi di laboratorio sugli ospiti definitivi e/o paratenici: le feci raccolte in siti di nidificazione di uccelli acquatici sono state sottoposte ad indagini parassitologiche standard per la ricerca di uova del parassita. Gli esemplari rinvenuti morti sono stati sottoposti ad esame necroscopico per la ricerca degli adulti del parassita nel proventricolo o comunque nell'apparato digerente.
-Raccolta di oligocheti o di eventuali altri ospiti invertebrati acquatici: sono stati prelevati campioni di fondale ad una profondità massima di 20 cm, da sottoporre ad un primo screening per la ricerca di eventuali anellidi oligocheti; questi, se presenti, sono stati sottoposti ad osservazione microscopica a fresco ed identificati; successivamente sono stati mantenuti in coltura e quindi sottoposti ad osservazione previa dissezione allo stereo microscopio, onde rilevare l'eventuale presenza di stadi larvali di Eustrongylides spp.
-Analisi di laboratorio sugli stadi parassitari: gli stadi parassitari evidenziati nei precedenti step sono stati sottoposti ad identificazione morfologica e molecolare. La prima si basa sull'osservazione microscopica del parassita e sul raffronto con chiavi tassonomiche e specifici articoli scientifici disponibili in letteratura. L'identificazione molecolare consiste nell'estrazione del DNA ed amplificazione di regioni specifiche, come riportato in letteratura, e successivo confronto con quanto disponibile nelle banche dati ufficiali.
-Analisi statistica: è stata effettuata una indagine trasversale conoscitiva, al fine di definire le variabili in studio ed il piano di campionamento. Per tale scopo sono stati individuati la popolazione target, la numerosità e la distribuzione dei campioni, onde definire e creare il database. Infine si è proceduto alla aggregazione/elaborazione dei dati ottenuti. In totale sono stati esaminati n. 125 campioni (di cui 105 pool di pesci da circa 1kg di peso ciascuno, 18 uccelli e 2 crostacei).
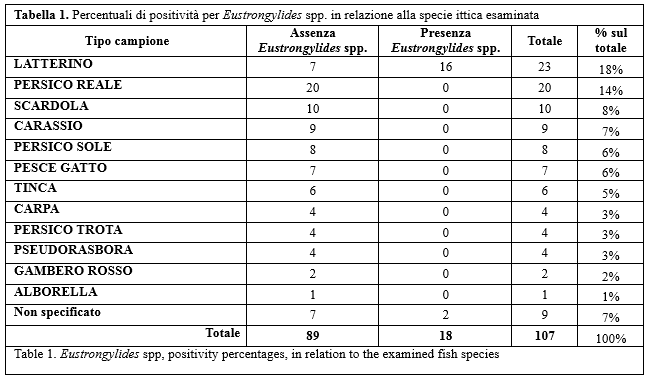
Per quanto concerne i pesci, n. 18 pool sono risultati positivi all'esame ispettivo per presenza di larve riferibili ad Eustrongylides spp. mentre i due campioni di crostacei sono risultati negativi. Nell'ambito delle diverse specie ittiche campionate, il latterino è risultato essere quello più parassitato. Fra gli uccelli invece, n. 12 su 18 sono risultati positivi all'esame necroscopico, per presenza di elementi parassitari riconducibili ad Eustrongylides spp. nel tratto gastroenterico. Gli esemplari maggiormente parassitati sono risultati essere quelli di cormorano. Per quanto riguarda i campioni fecali di uccelli ittiofagi, non si sono evidenziati in essi uova riconducibili a Dioctophymatidi. Di contro nel 17% dei campioni analizzati è stata rilevata una scarsa presenza di uova e larve di nematodi. Sulla base della morfologia le uova e le larve riscontrate sono state attribuite all'ordine Strongylida. Per quanto concerne l'identificazione morfologica degli stadi larvali e degli adulti parassitari rinvenuti negli ospiti ittici ed aviari, sono stati identificati in totale 56 esemplari appartenenti a Eustrongylides spp., di cui 5 larve provenienti da ospiti ittici e 51 adulti da ospiti aviari. Per quanto concerne le larve i caratteri morfologici non hanno consentito di giungere ad una loro identificazione di specie. Sulla base dei caratteri morfologici descritti gli adulti campionati sono stati invece identificati come Eustrongylides excisus. L'amplificazione mediante PCR della regione ITS rDNA ha permesso di ottenere 50 sequenze, mentre per 6 campioni non è stato possibile ottenere un amplificato. Per quanto riguarda l'amplificazione del gene COI mtDNA, nessuna delle coppie di primers impiegate ha permesso di ottenere l'amplificazione di Eustrongylides ma in tutti i casi del DNA dell'ospite. Globalmente, i dati ottenuti consentono di collocare Eustrongylides sp. nel contesto del lago Trasimeno; negli altri laghi umbri non è stata riscontrata presenza di tale parassita nei campioni esaminati. La presenza del nematode è stata dimostrata sia in campioni ittici che aviari, allo stadio larvale e/o adulto; a livello larvale non si è potuti arrivare ad un'identificazione di specie, ma solo di genere, invece gli adulti sono stati tipizzati come E. excisus. Parallelamente, nei campioni fecali di uccelli ittiofagi non è stata riscontrata la presenza di uova: ciò potrebbe essere riconducibile al fatto che i campionamenti di feci sono stati effettuati in periodi in cui non c'è eliminazione parassitaria da parte dell'ospite aviare. Si renderanno pertanto necessari ulteriori campionamenti di feci di uccelli, al fine di proseguire la ricerca delle uova e poter quindi definire il ciclo biologico completo del parassita nel contesto lacustre esaminato.
-Raccolta di campioni di origine ittica: è stata effettuata attraverso degli interventi di prelievo del pescato con cadenza prestabilita, al fine di individuare le specie ittiche più rappresentative (con particolare riguardo a P. fluviatilis) ed inviarle al laboratorio per la ricerca degli stadi larvali del parassita.
-Raccolta di campioni da uccelli acquatici: è stata effettuata attraverso sopralluoghi per individuare aree di nidificazione degli uccelli acquatici e poter così reperire campioni fecali da sottoporre ad esami coproparassitologici, in grado di evidenziare eventuali uova del parassita. Parallelamente, è stata condotta una sorveglianza passiva sugli uccelli acquatici (o eventuali ospiti paratenici quali anfibi e/o rettili) rinvenuti morti nelle zone limitrofe ai bacini lacustri considerati, onde poter ricercare gli adulti di Eustrongylides spp.
-Analisi di laboratorio per la ricerca di stadi larvali in matrici ittiche: i campioni di pesce prelevati sono stati sottoposti ad esame ispettivo e successiva digestione artificiale, per la ricerca di larve di Eustrongylides sp.
-Analisi di laboratorio sugli ospiti definitivi e/o paratenici: le feci raccolte in siti di nidificazione di uccelli acquatici sono state sottoposte ad indagini parassitologiche standard per la ricerca di uova del parassita. Gli esemplari rinvenuti morti sono stati sottoposti ad esame necroscopico per la ricerca degli adulti del parassita nel proventricolo o comunque nell'apparato digerente.
-Raccolta di oligocheti o di eventuali altri ospiti invertebrati acquatici: sono stati prelevati campioni di fondale ad una profondità massima di 20 cm, da sottoporre ad un primo screening per la ricerca di eventuali anellidi oligocheti; questi, se presenti, sono stati sottoposti ad osservazione microscopica a fresco ed identificati; successivamente sono stati mantenuti in coltura e quindi sottoposti ad osservazione previa dissezione allo stereo microscopio, onde rilevare l'eventuale presenza di stadi larvali di Eustrongylides spp.
-Analisi di laboratorio sugli stadi parassitari: gli stadi parassitari evidenziati nei precedenti step sono stati sottoposti ad identificazione morfologica e molecolare. La prima si basa sull'osservazione microscopica del parassita e sul raffronto con chiavi tassonomiche e specifici articoli scientifici disponibili in letteratura. L'identificazione molecolare consiste nell'estrazione del DNA ed amplificazione di regioni specifiche, come riportato in letteratura, e successivo confronto con quanto disponibile nelle banche dati ufficiali.
-Analisi statistica: è stata effettuata una indagine trasversale conoscitiva, al fine di definire le variabili in studio ed il piano di campionamento. Per tale scopo sono stati individuati la popolazione target, la numerosità e la distribuzione dei campioni, onde definire e creare il database. Infine si è proceduto alla aggregazione/elaborazione dei dati ottenuti. In totale sono stati esaminati n. 125 campioni (di cui 105 pool di pesci da circa 1kg di peso ciascuno, 18 uccelli e 2 crostacei).
Per quanto concerne i pesci, n. 18 pool sono risultati positivi all'esame ispettivo per presenza di larve riferibili ad Eustrongylides spp. mentre i due campioni di crostacei sono risultati negativi. Nell'ambito delle diverse specie ittiche campionate, il latterino è risultato essere quello più parassitato. Fra gli uccelli invece, n. 12 su 18 sono risultati positivi all'esame necroscopico, per presenza di elementi parassitari riconducibili ad Eustrongylides spp. nel tratto gastroenterico. Gli esemplari maggiormente parassitati sono risultati essere quelli di cormorano. Per quanto riguarda i campioni fecali di uccelli ittiofagi, non si sono evidenziati in essi uova riconducibili a Dioctophymatidi. Di contro nel 17% dei campioni analizzati è stata rilevata una scarsa presenza di uova e larve di nematodi. Sulla base della morfologia le uova e le larve riscontrate sono state attribuite all'ordine Strongylida. Per quanto concerne l'identificazione morfologica degli stadi larvali e degli adulti parassitari rinvenuti negli ospiti ittici ed aviari, sono stati identificati in totale 56 esemplari appartenenti a Eustrongylides spp., di cui 5 larve provenienti da ospiti ittici e 51 adulti da ospiti aviari. Per quanto concerne le larve i caratteri morfologici non hanno consentito di giungere ad una loro identificazione di specie. Sulla base dei caratteri morfologici descritti gli adulti campionati sono stati invece identificati come Eustrongylides excisus. L'amplificazione mediante PCR della regione ITS rDNA ha permesso di ottenere 50 sequenze, mentre per 6 campioni non è stato possibile ottenere un amplificato. Per quanto riguarda l'amplificazione del gene COI mtDNA, nessuna delle coppie di primers impiegate ha permesso di ottenere l'amplificazione di Eustrongylides ma in tutti i casi del DNA dell'ospite. Globalmente, i dati ottenuti consentono di collocare Eustrongylides sp. nel contesto del lago Trasimeno; negli altri laghi umbri non è stata riscontrata presenza di tale parassita nei campioni esaminati. La presenza del nematode è stata dimostrata sia in campioni ittici che aviari, allo stadio larvale e/o adulto; a livello larvale non si è potuti arrivare ad un'identificazione di specie, ma solo di genere, invece gli adulti sono stati tipizzati come E. excisus. Parallelamente, nei campioni fecali di uccelli ittiofagi non è stata riscontrata la presenza di uova: ciò potrebbe essere riconducibile al fatto che i campionamenti di feci sono stati effettuati in periodi in cui non c'è eliminazione parassitaria da parte dell'ospite aviare. Si renderanno pertanto necessari ulteriori campionamenti di feci di uccelli, al fine di proseguire la ricerca delle uova e poter quindi definire il ciclo biologico completo del parassita nel contesto lacustre esaminato.
Introduzione
L'Eustrongilidosi è una parassitosi degli uccelli ittiofagi e dei pesci dulciacquicoli sostenuta rispettivamente da adulti e larve di nematodi appartenenti al genere Eustrongylides (Nematoda, Dioctophymatidae), anche nota nei paesi anglofoni come Big Red Worm Disease. Le specie appartenenti a questo genere ad oggi considerate valide sono tre, Eustrongylides tubifex, E. ignotus ed E. excisus, segnalate in tutto il mondo come responsabili di importanti picchi di mortalità tra i nidiacei di moltissime specie aviarie appartenenti a sette ordini tassonomici differenti (Measures, 1988a). Questi parassiti presentano un ciclo biologico indiretto legato ad ambienti dulciacquicoli che si realizza attraverso due ospiti intermedi ed un ospite definitivo (Figura 1).
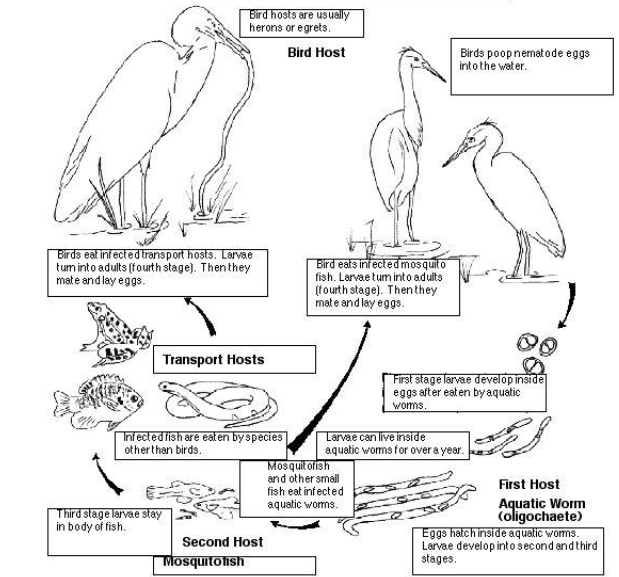
Ciclo biologico Eustrongilidosi
Eustrongilidosi biological cycle
By Emily Hesch, College Meadville, Pennsylvania (2014)
Il primo ospite intermedio è rappresentato da anellidi oligocheti di acqua dolce, individuati quali ospiti idonei mediante prove di infezione sperimentale, mentre sono molte le specie di pesci bentonici che possono rivestire il ruolo di secondo ospite intermedio; in questi animali si sviluppano larve infettanti di quarto stadio incapsulate a livello della muscolatura e della sierose viscerali (Paperna, 1974; Cooper et al., 1978). Pesci predatori, anfibi e rettili possono rientrare nel ciclo del parassita come ospiti paratenici, in grado anch'essi di accumulare le larve del parassita a livello di sierose viscerali e/o di muscolatura (Goncharov et al., 2018).
Diverse specie di uccelli ittiofagi possono fungere da ospite definitivo, in particolare il cormorano comune (Phalacrocorax carbo) (El Dakhly et al., 2012; Stocka et al., 2017). Nelle specie aviarie i parassiti adulti si localizzano nello spessore della parete del proventricolo, meno frequentemente di ventricolo e intestino, dove inducono la formazione di importanti tragitti cavitari e di imponenti reazioni granulomatose intorno al sito di penetrazione e attacco (Measures, 1988a; Cole, 1999; Xiong et al., 2009).
L'interesse del mondo scientifico e medico-veterinario nei confronti di questi parassiti si è sviluppato negli ultimi anni, oltre che alla luce della sua elevata patogenicità negli uccelli ittiofagi, soprattutto a seguito di alcune segnalazioni di casi umani che ne hanno evidenziato il potenziale zoonosico (Eiras et al., 2018). Gli stadi larvali presenti negli ospiti ittici possono infatti essere trasmessi all'uomo per ingestione di prodotti ittici parassitati non sottoposti ad adeguata cottura o congelamento.
Nell'uomo questi nematodi provocano sindromi gastroenteriche che si possono manifestare con forme lievi di gastriti o enteriti fino a quadri clinici molto più importanti con perforazione della parete gastrica o intestinale; nel caso in cui le larve si localizzino nello spessore della parete del tubo digerente, l'unico trattamento praticabile e risolutivo è la rimozione chirurgica del parassita (Eberhard et al., 1989). Recentemente sono stati segnalati anche casi di Eustrongilidosi cutanea (Eberhard et al., 2014).
La parassitosi in popolazioni aviarie ed ittiche è ampiamente descritta in America settentrionale e meridionale, Giappone, Australia, Africa, Russia ed in diversi paesi Europei.
Per quanto concerne l'Italia, la presenza di stadi larvali di Eustrongylides spp. in pesci di acqua dolce è stata recentemente riportata in esemplari di pesce persico (Perca fluviatilis) pescati nel lago Trasimeno (Dezfuli et al., 2015; Branciari et al., 2016). Tale reperto assume un particolare interesse in quanto in tale contesto lacustre insiste una forte attività di pesca, unitamente ad una diversificata offerta di prodotti ittici nel settore della ristorazione locale.
Scopo del presente progetto è stato pertanto quello di approfondire l'epidemiologia di Eustrongylides spp. nel lago Trasimeno e negli altri laghi umbri, per poterne comprendere i meccanismi di trasmissione, apportare idonee azioni di sorveglianza ed applicare eventuali misure di controllo, anche alla luce della normativa vigente in materia di consumo e commercializzazione di prodotti ittici crudi e/o poco cotti. Dal punto di vista pratico il progetto ha previsto l'esecuzione delle seguenti fasi:
- Raccolta di campioni di origine ittica: effettuata attraverso degli interventi di prelievo del pescato con cadenza prestabilita, al fine di individuare le specie ittiche più rappresentative (con particolare riguardo a Perca fluviatilis) da cui poi effettuare la ricerca degli stadi larvali del parassita. Oltre a diverse specie ittiche, si è effettuato anche un campionamento di crostacei.
- Raccolta di campioni da uccelli acquatici: il monitoraggio degli uccelli acquatici afferenti alle aree lacustri oggetto di indagine è fondamentale per evidenziare l'eventuale presenza dello stadio adulto del parassita. A tal fine, sono stati effettuati sopralluoghi per individuare aree di nidificazione degli uccelli e poter così reperire campioni fecali da sottoporre ad esami coproparassitologici, in grado di evidenziare eventuali uova del parassita. Parallelamente, è stata condotta una sorveglianza passiva sugli uccelli acquatici (o eventuali ospiti paratenici quali anfibi e/o rettili) rinvenuti morti nelle zone limitrofe ai bacini lacustri considerati, onde poter ricercare gli adulti di Eustrongylides spp.
- Analisi di laboratorio per la ricerca di stadi larvali in matrici ittiche: i campioni di pesce prelevati sono stati sottoposti ad esame ispettivo e successiva digestione artificiale, per la ricerca di larve di Eustrongylides spp.
- Analisi di laboratorio sugli ospiti definitivi e/o paratenici: le feci raccolte in siti di nidificazione di uccelli acquatici sono state sottoposte ad indagini parassitologiche standard per la ricerca di uova del parassita. Gli eventuali esemplari rinvenuti morti, sono stati sottoposti ad esame necroscopico per la ricerca degli adulti del parassita nel ventricolo o comunque nell'apparato digerente.
- Raccolta di oligocheti o di eventuali altri ospiti invertebrati acquatici: sono stati prelevati campioni di fondale ad una profondità massima di 20cm, per la ricerca di eventuali anellidi oligocheti; questi, quando presenti, sono stati sottoposti ad osservazione microscopica a fresco ed identificati; successivamente sono stati mantenuti in coltura e quindi sottoposti ad osservazione previa dissezione allo stereo microscopio, onde rilevare l'eventuale presenza di stadi larvali di Eustrongylides sp.
- Analisi di laboratorio sugli stadi parassitari: gli stadi parassitari evidenziati nei precedenti step sono stati sottoposti ad identificazione morfologica e molecolare. La prima si è basata sull'osservazione microscopica del parassita e sul raffronto con chiavi tassonomiche e specifici articoli scientifici disponibili in letteratura. L'identificazione molecolare è consistita nell'estrazione del DNA ed amplificazione di regioni specifiche, come riportato in letteratura (Xiong et al., 2013), e successivo confronto con quanto disponibile nelle banche dati ufficiali.
- Analisi statistica: è stata effettuata attraverso lo sviluppo dei seguenti punti:
- indagine trasversale conoscitiva
- definizione delle variabili in studio
- definizione del piano di campionamento:
- individuazione della popolazione target
- individuazione della numerosità e distribuzione dei campioni
- definizione del database
- creazione del database
- aggregazione/elaborazione dei dati
Materiali e metodi
Analisi su matrici ittiche
Sono stati prelevati un totale di n. 107 pool di esemplari ittici di circa 1kg di peso ciascuno, rappresentati dalle seguenti specie: n. 23 latterini (Atherina boyeri), n. 20 persici reali (Perca fluviatilis), n. 10 scardole (Scardinius erythrophthalmus), n. 9 carassi (Carassius carassius), n. 8 persici sole (Lepomis gibbosus), n. 7 pesci gatto (Ictalurus melas), n. 6 tinche (Tinca tinca), n. 4 carpe (Cyprinus carpio), n. 4 persici trota (Micropterus salmoides), n. 4 pseudorasbore (Pseudorasbora parva), n. 1 alborella (Alburnus alburnus alborella), n. 2 gamberi rossi (Procambarus clarkii) e n. 9 specie di pesci non identificati. Di questi n. 107 pool, n. 93 provenivano dal lago Trasimeno (PG) e n. 12 dal lago di Piediluco (TR). I campionamenti sono stati effettuati dagli operatori del Servizio Veterinario delle AA.SS.LL. umbre n. 1 e 2, presso cooperative di pesca locali. I pesci in questione sono stati sottoposti ad esame anatomo-patologico standard, con particolare attenzione alla visualizzazione di larve ascrivibili ad Eustorngylides spp. Le eventuali larve rinvenute in sede di esame visivo sono state lavate in soluzione fisiologica e fissate in alcol etilico al 70%. I campioni così conservati, sono stati poi sottoposti a tipizzazione morfologica e molecolare. Accanto all'esame visivo sono stati allestiti anche dei pool di muscolo (50 g) da sottoporre a digestione artificiale con una soluzione contenente 7 g di pepsina e 4 ml di acido cloridrico in 1 litro di acqua deionizzata. Il materiale viene poi miscelato mediante agitatore magnetico alla temperatura di 40 °C overnight, filtrato con setaccio a maglie da 500 ?m ed osservato allo stereomicrosopio, al fine di evidenziare eventuali micro larve presenti (Gustinelli, 2008).
Analisi su specie aviari acquatiche Sono stati analizzati un totale di n. 18 uccelli acquatici, rappresentati nello specifico da n. 9 cormorani (Phalacrocorax carbo), n. 7 svassi maggiori (Podiceps cristatus) e n. 2 moriglioni (Aythya ferina). Tali esemplari, rinvenuti morti dagli operatori delle cooperative di pesca locali afferenti ai bacini lacustri considerati, sono stati sottoposti ad esame necroscopico, con particolare attenzione nei confronti del proventricolo e/o dell'apparato digerente in toto, punti di elezione per la ricerca degli adulti. Infatti, nello specifico, il parassita si localizza penetrando nello spessore della parete del proventricolo, pertanto bisogna porre particolare attenzione durante il prelievo poiché è molto frequente che si verifichi la rottura dell'estremità cefalica, rendendo difficoltosa la successiva identificazione morfologica; si è quindi deciso di procedere asportando direttamente il frammento di mucosa con adeso il parassita.
Parallelamente, la ricerca di parassiti adulti nell'apparato digerente dei volatili, è stata eseguita anche con le modalità riportate nel manuale M.A.F.F. (1986). Il materiale raccolto dal tratto gastroenterico mediante lavaggio dei comparti è stato vagliato in setacci metallici sovrapposti con maglie rispettivamente di 200 e 30 µm. Il contenuto filtrato è stato quindi recuperato ed osservato su piastra Petri allo stereo microscopio (6.4-16x) per isolare gli eventuali parassiti adulti.
Un campione di contenuto intestinale è stato destinato ad esami copro parassitologici per flottazione.
Per la raccolta di campioni di guano di uccelli acquatici, quali cormorani e svassi, al fine di individuare l'eventuale presenza di uova di Eustrongylides spp. e quindi definirne il loro ruolo attivo di ospiti definitivi nel ciclo biologico del parassita, è stato condotto uno studio bibliografico e sono stati presi contatti con i responsabili dei piani regionali di monitoraggio dell'avifauna umbra per individuare le aree di addensamento degli uccelli dove concentrare i prelievi e per definire i periodi dell'anno ottimali al campionamento di materiale da destinare alle indagini parassitologiche. Si fa presente che nella zona del Trasimeno ad oggi non è stato ancora possibile individuare siti di nidificazione ma soltanto i cosiddetti siti "dormitori", vale a dire siti circoscritti nei quali cormorani e svassi si radunano in grandi numeri per passare la notte e dove depositano guano. Dal momento che nell'area del Trasimeno il principale sito dormitorio è rappresentato dall'Isola Minore (che però risulta di proprietà privata, quindi non accessibile), i sopralluoghi sono stati condotti in due siti collaterali (località di San Savino e località Braccio) che risultano comunque frequentati dalle specie aviari d'interesse e da altre specie di uccelli acquatici, quali airone cenerino, garzetta, airone guardabuoi; i sopralluoghi per ciascun sito sono stati eseguiti in 2 distinti momenti dell'anno.
Il primo campionamento è stato condotto a novembre 2017 (10/11/2017, 23/11/2017) ed il successivo a maggio 2018 (16/05/2018, 23/05/2018), quando però gli animali erano oramai quasi tutti ripartiti verso i quartieri riproduttivi. Nei mesi centrali dell'inverno (novembre - marzo), che rappresentano quelli dove maggiore è il numero di animali (circa 5.000 individui svernanti in tutta l'area del Trasimeno, contro soltanto un centinaio estivanti), non è stato possibile eseguire ulteriori campionamenti, dal momento che l'elevato tasso di precipitazione che ha caratterizzato la stagione invernale 2017-2018 non ha reso possibile l'avvicinamento alle aree di riposo degli animali e la raccolta del guano che cadeva in acqua. Nel corso di ciascun campionamento, le aree di indagine di ciascun sito sono state idealmente suddivise in quadranti di circa 400 m2 l'uno; per ciascun sito sono stati campionati in linea retta 5 quadranti. All'interno di ciascun quadrante, nell'area di interfaccia tra il bagnasciuga e la vegetazione immediatamente retrostante dove si trovano le canne palustri e dove vanno a posarsi gli animali, sono stati sistemati dei teli di plastica mantenuti per circa 5 h in situ, da questi, tramite l'ausilio di una spatola o cucchiaino, è stato asportato il guano. Nel corso di ciascun sopralluogo sono stati raccolti 5 campioni di pool di guano di circa 15 grammi l'uno.
Complessivamente nel corso dei campionamenti sono stati raccolti n. 100 campioni. I campioni conservati in buste di plastica a temperatura di refrigerazione (+4°C) sono stati trasportati in laboratorio per essere analizzati. In laboratorio ciascun campione è stato poi suddiviso in due distinte aliquote di cui una da destinare alle indagini coproparassitologiche e l'altra invece da conservare a -20°C per ulteriori indagini molecolari nel caso di positività rilevata. La ricerca qualitativa di uova di Eustrongylides spp. è stata condotta mediante una tecnica di arricchimento per flottazione, utilizzando una soluzione composta da sodio nitrato e zucchero (peso specifico 1,350). I preparati allestiti sono stati quindi osservati al microscopio ottico (Leica DMLB).
Analisi su campioni di invertebrati acquatici
Al fine di reperire eventuali invertebrati acquatici (anellidi), sono stati scelti tre differenti siti di campionamento nel lago Trasimeno (San Feliciano, Sant'Arcangelo di Magione e Castiglione del Lago); qui sono stati prelevati 4 campioni di materiale presente sul fondale da punti diversi, ad una profondità massima di circa 20 cm (Figura 2) mediante l'ausilio di setacci in alluminio con maglie da 500 µm. I prelievi per ciascun sito sono stati condotti in due periodi dell'anno, il primo a giugno 2017 ed il secondo a marzo 2018.
Figura 2. Campionamento nel lago Trasimeno
Figure 2. sampling in Trasimeno lake
Il materiale è stato successivamente trasportato in laboratorio, dove è stato sottoposto a lavaggio mediante setacciamento, allo scopo di trattenere gli eventuali anellidi presenti; gli anellidi ottenuti sono stati raccolti dal setaccio con l'ausilio di una piuma o di una pipetta e posti in acqua proveniente dal punto di raccolta. Gli anellidi sono stati quindi separati in base alle loro dimensioni come "grandi" e "piccoli". Per l'identificazione, sono stati poi sottoposti ad osservazione allo stereo microscopio e al microscopio ottico, al fine di valutarne in primis le caratteristiche morfologiche secondo le chiavi identificative di Brinkhurst & Jamieson (1971) ed al contempo verificare se contenessero larve di nematodi.
Analisi su larve e/o adulti di Eustrongylides spp.
Sui nematodi reperiti dalle specie ittiche ed aviari esaminate sono stati condotti sia esami morfologici che molecolari.
Identificazione morfologica: è stata effettuata su un totale di 65 nematodi, di cui 10 larve e 55 adulti. Le larve provenivano dai filetti e dalle sierose viscerali degli esemplari ittici, in particolare persico reale e latterino. Gli adulti del parassita sono stati invece estratti da due porzioni di proventricolo fissate in etanolo 85% prelevate da due cormorani rinvenuti morti in prossimità delle sponde del lago Trasimeno. Tutti i nematodi, dopo il prelievo di una piccola porzione mediana del corpo destinata alle analisi molecolari, sono stati chiarificati con lattofenolo di Amman e sottoposti ad osservazione microscopica per la valutazione dei caratteri morfologici utili alla loro identificazione a livello di genere (Measures, 1988b; Anderson et al., 2009). Successivamente si è proceduto, per quanto concerne i nematodi ascrivibili al genere Eustrongylides alla rilevazione dei caratteri morfometrici utili tassonomicamente al raggiungimento dell'identificazione di specie, secondo quanto riportato da Karmanova (1968) e Measures (1988b); tali misurazioni sono state condotte mediante l'utilizzo di microscopio ottico dotato di fotocamera digitale e con l'ausilio di un software di analisi di immagine computerizzato.
Tipizzazione molecolare: è stata condotta sulla porzione mediana del corpo dei parassiti esaminati, prelevata prima della loro chiarificazione in lattofenolo di Amman. Sono stati sottoposti ad indagini molecolari tutti gli esemplari ascrivibili al genere Eustrongylides su base morfologica. L'estrazione del DNA è stata condotta con un kit del commercio, PureLink® Genomic DNA (Life Technologies), seguendo il protocollo indicato dal produttore, apportando opportune modifiche in determinati passaggi. Il prodotto ottenuto è stato conservato a -20°C fino al momento dell'utilizzo; successivamente si è proceduto all'amplificazione mediante PCR dei marcatori molecolari d'interesse: ITS rDNA e COI mtDNA. La regione ITS rDNA è stata amplificata con l'impiego dei primers riportati da Gustinelli et al. (2010) mentre per il DNA mitocondriale COI sono state impiegate diverse coppie di primers descritti da Moszczynska et al. (2009) e Van Steenkiste et al. (2015). Al termine dell'amplificazione, i frammenti sono stati sottoposti ad elettroforesi su gel di agarosio all'1% in 0,5X TBE utilizzando come intercalante del DNA il Sybr Safe DNA Gel Stain . Alla fine della corsa elettroforetica il gel è stato osservato mediante Safe ImagerTM e fotografato con camera digitale.
Per il sequenziamento, i prodotti di PCR ottenuti dall'amplificazione dei vari geni, sono stati purificati. In particolare la banda di interesse è stata tagliata direttamente da gel con un bisturi sterile e di seguito sottoposta a purificazione mediante il kit del commercio NucleoSpin® Gel and PCR Cleanup (Macherey Nagel). I campioni così purificati sono stati inviati al servizio di sequenziamento StarSEQ GmbH (Mainz, Germania) e sequenziati mediante ABI 3730 DNA Analyzer.
Le sequenze ottenute sono state corrette ed assemblate mediante il software Vector NTI Advance 11.0 (Invitrogen). Sono state quindi prima confrontate con quelle presenti in banche dati (GenBank) mediante BLAST, con lo scopo di verificare la loro similarità per poi allinearle con ClustalW di Bioedit 7.2.5. La pairwise distance è stata calcolata con MEGA 6, impiegando il modello p-distance, che valuta la percentuale di siti polimorfici tra le sequenze in esame. Sem pre con l'ausilio di questo software è stata condotta l'analisi filogenetica impiegando il modello Neighbor-Joining (NJ) ed valore di bootstrap di 1000 replicati.
Analisi statistica
E' stata effettuata un'analisi descrittiva dei dati, relativamente all'esame ispettivo eseguito sui campioni ittici e sull'esame necroscopico condotto sulle specie aviari. Si sono valutati i seguenti parametri:
- numerosità dei campioni nel periodo di decorrenza della ricerca, valutandone la distribuzio-ne percentuale per anno e per mese;
- distribuzione e percentuale di presenza di Eustrongylides spp. per anno;
- distribuzione dei campioni per ambiente di provenienza e presenza di Eustrongylides spp.;
- distribuzione dei campioni per origine del campione e presenza di Eustrongylides spp.
Analisi su matrici ittiche
Dei n. 107 pool di esemplari ittici ispezionati, n. 18 sono risultati positivi per elementi parassitari macroscopicamente riconducibili a nematodi Eustrongylides spp. La Tabella 1 mostra le percentuali di positività in relazione alla specie ittica. I parassiti riscontrati mostravano una forma allungata, un colorito rossastro e lunghezza variabile da 15 a 20 mm circa.
In P. fluviatilis i parassiti evidenziati risultavano disseminati nella muscolatura scheletrica dei fianchi (Figura 3), mentre nel latterino si rinvenivano prevalentemente a livello del tratto digerente o intercalati nelle sierose del pacchetto viscerale della cavità celomatica.
Figura 3. Larva L4 di Eustrongylides spp. nella muscolatura scheletrica di P. fluviatilis
Figure 3. L4 larva of Eustrongylides spp. in the skeletal musculature of P. fluviatilis
In alcuni casi i parassiti si sono riscontrati al di fuori del corpo del pesce, a seguito di probabile perforazione dello stesso e fuoriuscita (Figura 4). La digestione artificiale su pool di muscolo non ha evidenziato presenza di larve riconducibili al parassita oggetto di studio.
Figura. 4. Larva L4 di Eustrongylides spp. fuoriuscita da esemplare di latterino
Figure 4. L4 larva of Eustrongylides spp. emission from a specimen of sand smelt
Analisi su specie aviari acquatiche
Dei n. 18 esemplari di volatili sottoposti ad esame necroscopico, n. 8 cormorani e n. 4 svassi hanno mostrato presenza di elementi parassitari macroscopicamente riconducibili a larve di Eustrongylides spp., penetranti lo spessore della parete del proventricolo (Figura 5).
Figura 5. Larva L4 di Eustrongylides spp. penetrante la parete dello stomaco ghiandolare di Podiceps cristatus
Figure 5. L4 larva of Eustrongylides spp. penetrating the wall of the glandular stomach of Podiceps cristatus
Per quanto riguarda invece i campioni di guano, l'osservazione dei preparati ottenuti per flottazione non ha evidenziato alcun tipo di elemento riconducibile a uova di Dioctophymatidae. Di contro nel 17% dei campioni analizzati è stata rilevata una scarsa presenza di uova e larve di nematodi. Sulla base della morfologia le uova e le larve riscontrate sono state attribuite all'ordine Strongylida, senza però un'esatta definizione del genere e specie in causa. Dal momento che alcune delle uova reperite erano larvate, con molta probabilità le larve L1 riscontrate sono da attribuire alla schiusa di uova di strongilidi presenti nelle feci; è stato tentato l'allestimento della tecnica di Baermann per il recupero e la tipizzazione delle larve dai pool fecali, ma senza successo.
Analisi su campioni di invertebrati acquatici
Nei tre siti di campionamento sono stati raccolti complessivamente 111 anellidi, che in base alle loro caratteristiche morfologiche sono stati identificati come oligocheti. Di questi 68 erano "grandi" e 43 "piccoli". Sono stati rinvenuti inoltre 23 porzioni di oligocheti, che non presentavano caratteri morfologici sufficienti per una loro identificazione.
Per quanto riguarda l'identificazione morfologica, gli oligocheti "grandi" erano caratterizzati dalla peculiare presenza nella regione posteriore del corpo di branchie, poste in ciascun segmento. Erano presenti setole distinte in ciuffi dorsali anteriori, con 1-3 setole capillari corte e 4-6 setole bifide con dente superiore ridotto rispetto all'inferiore e talora pettinate, ciuffi dorsali posteriori, con 2-4 setole bifide anch'esse con lo stesso andamento delle dorsali. Le setole non apparivano con denti ben separati tra loro.
In base alle caratteristiche morfologiche peculiari osservate, gli oligocheti "grandi" sono stati identificati tutti come Branchiura sowerbyi. Per quanto riguarda gli oligocheti "piccoli" sono stati identificati come appartenenti alla famiglia Tubificidae, ma non è stato possibile giungere ad una identificazione di genere e specie. In nessuno degli esemplari esaminati è stata individuata la presenza di stadi larvali di nematodi.
Analisi su larve e/o adulti di Eustrongylides spp.
Identificazione morfologica: l'osservazione dei caratteri morfologici dei nematodi esaminati ha permesso una loro iniziale suddivisione in due generi, talvolta contemporaneamente presenti nei campioni analizzati. Si riportano in Tabella 2 i risultati ottenuti in questa fase.
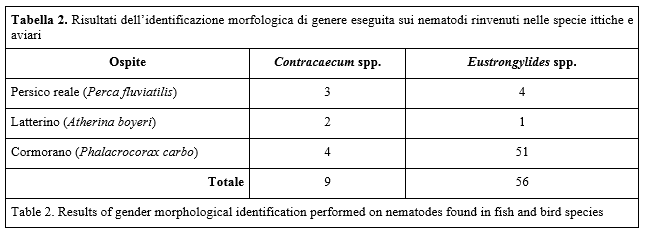
L'identificazione del genere è stata condotta attenendosi a quanto riportato da Measures (1988b) per quanto concerne i caratteri tassonomicamente rilevanti di Eustrongylides spp. e a quanto riportato da Anderson et al. (2009) per quanto riguarda invece i caratteri morfologici ascrivibili al genere Contracaecum.
Sono stati dunque identificati un totale di 56 esemplari appartenenti al genere Eustrongylides di cui 5 larve provenienti da ospiti ittici e 51 adulti da ospiti aviari. Gli esemplari estratti dai campioni di proventricolo di cormorano presentavano le estremità visibili sulla superficie mucosa dell'organo, mentre la parte centrale del corpo si approfondava nello spessore della parete; alcune femmine gravide sono state estratte da strutture cave chiuse che le circondavano completamente e le isolavano dal resto del tessuto.
Per quanto concerne le larve non è stato possibile giungere ad una loro identificazione di specie a causa dall'assenza di caratteri morfologici sufficienti a giungere a tale livello tassonomico, come già evidenziato in passato da altri autori. Per quanto riguarda invece gli adulti, sulla base dei caratteri morfologici riscontrati, sono stati identificati come Eustrongylides excisus.
Tipizzazione molecolare: l'amplificazione mediante PCR della regione ITS rDNA ha permesso di ottenere 50 sequenze, mentre per 6 campioni non è stato possibile ottenere un amplificato. Per quanto riguarda l'amplificazione del gene COI mtDNA, nessuna delle coppie di primers impiegate ha permesso di ottenere l'amplificazione di Eustrongylides ma in tutti i casi del DNA dell'ospite (Atherina boyeri e Phalacrocorax carbo). L'assenza di un prodotto di PCR specifico potrebbe essere imputato all'ecologia di questi parassiti che, nutrendosi dei tessuti e del sangue dell'ospite, contenevano residui cellulari con materiale genetico dell'ospite all'interno del tubo digerente. Per ovviare a questo inconveniente sarebbe certamente utile disegnare primers specifici per il genere Eustrongylides.
Tutte le 50 sequenze ITS rDNA ottenute sono risultate uguali tra di loro così come tra adulti e larve, permettendo di confermare la loro appartenenza ad un'unica specie, che sulla base delle osservazioni morfologiche è stata identificata come Eustrongylides excisus.
Analisi statistica
Da settembre 2015 ad ottobre 2018 sono stati testati un totale di n. 125 campioni. Il maggior numero di questi è stato testato nel 2017, con una percentuale del 60% del totale. Il maggior numero di campioni è pervenuto nella seconda metà dell'anno, in tutti gli anni presi in considerazione, specialmente nel mese di novembre, rilevando un picco nel mese di agosto 2017. Complessivamente nel quadriennio i mesi con il più alto numero di campioni accettati sono stati novembre, agosto e luglio. Dal 2015 al 2018 il numero di campioni positivi per presenza di Eustrongylides spp. sono stati 30 su 125. La prevalenza stimata nel periodo in studio è stata del 24%, con intervalli di confidenza del 95% che oscillano tra 16,51% e il 31,49%.
La percentuale più alta di presenza di Eustrongylides spp. è stata riscontrata nel 2016 (40%), mentre la percentuale più bassa di presenza è stata rilevata nel 2017 (17%). Il 90% dei campioni testati provenivano dal lago Trasimeno (n. 113), mentre il 10% dal lago di Piediluco (n. 12); la distribuzione percentuale è stata rappresentata nel Grafico 1. Tutti i campioni trovati con presenza di Eustrongylides spp. sono stati prelevati nel lago Trasimeno.
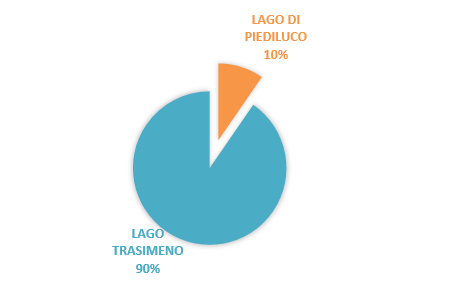
Grafico 1. Distribuzione dei campioni per ambiente di prelevamento
Graph 1. Specimen distribution by sampling environment
I pesci sono stati il gruppo di animali maggiormente testato, 84% del totale, seguito dagli uccelli (14%) e dai crostacei (2%). Tutti gli uccelli e i crostacei sono stati prelevati presso il lago Trasimeno mentre i 12 pool di pesci dei 105 testati sono stati campionati presso il lago di Piediluco. Per quanto riguarda la presenza di Eustrongylides spp., questa è stata trovata solo negli animali del lago Trasimeno ed il numero più alto di positivi (n. 18) è stato riscontrato nei pesci; la percentuale più alta di positività si è invece avuta negli uccelli (67%) (Grafico 2).
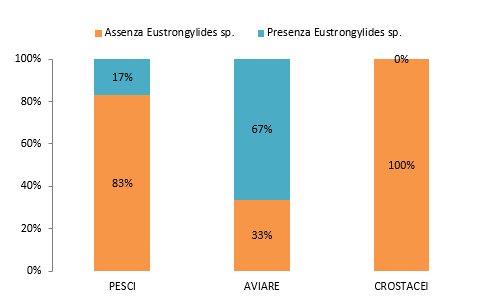
Grafico 2. Distribuzione dei campioni per origine del campione e presenza di Eustrongylides spp.
Graph 2. Distribution of samples by origin and presence of Eustrongylides spp.
Discussione e conclusioni
Il progetto di ricerca qui descritto, visto il recente riscontro del parassita oggetto di studio nelle zone lacustri del comprensorio umbro, è nato con l'esigenza di approfondire gli aspetti epidemiologici e la biologia di Eustrongylides sp., al fine di poterne comprendere i meccanismi di diffusione e trasmissione, per poter successivamente attuare adeguate azioni di sorveglianza e/o eventuali misure contenitive, sulla base anche della normativa vigente in materia di consumo di prodotti ittici crudi e/o poco cotti.
La parassitosi risulta ampiamente descritta in uccelli ittiofagi, pesci, anfibi e rettili in America settentrionale e meridionale, Giappone, Australia, Africa, Russia ed in diversi paesi europei ma solo nel 2015, il parassita è stato per la prima volta descritto in specie ittiche italiane, in particolare in pesci persico (Perca fluviatilis) pescati nel lago Trasimeno (Umbria), dimostrandone la presenza a livello muscolare e studiandone il quadro istopatologico e la risposta infiammatoria tissutale dell'ospite. Alcuni autori descrivono i meccanismi di azione e i danni che il nematode è in grado di determinare negli organi e tessuti dell'ospite ma si conosce ancora ben poco circa gli aspetti correlati all'epidemiologia e al ciclo biologico del parassita.
Il gruppo di ricerca ha individuato i diversi criteri di indagine a seconda del tipo di ospite considerato:
- ospiti invertebrati: campionamenti finalizzati ad effettuare un monitoraggio "esplorativo"; i sopralluoghi sono stati pianificati in modo tale da essere rappresentativi della diversa stagionalità del periodo;
- ospiti definitivi (uccelli ittiofagi): una volta identificata la localizzazione dei siti di nidificazione degli uccelli potenzialmente coinvolti nel ciclo parassitario, sono stati effettuati campionamenti di feci presenti nei siti identificati. Parallelamente, sono stati prelevate forme larvali e/o di parassiti adulti in uccelli ittiofagi provenienti dai laghi oggetto di indagine e pervenuti presso il laboratorio con richiesta di esame anatomopatologico, a seguito di mortalità (sorveglianza passiva);
- pesci: i campionamenti sulle specie ittiche si sono svolti contestualmente a quelli previsti dalle UU.SS.LL. territorialmente competenti per il monitoraggio della fauna ittica lacustre. Si è comunque deciso di considerare la popolazione ittica distinta per singola specie, dando priorità al persico ed al latterino.
Gli esemplari sono stati conteggiati come campioni di pool aggregati. Le restanti specie ittiche potenzialmente coinvolte (aventi comunque un destino commerciale e quindi un risvolto in sanità pubblica) sono state considerate in base alla disponibilità del pescato.
Anche i dati ottenuti dalle indagini sulle specie aviari si allineano con quanto riscontrato da altri autori, soprattutto per quanto riguarda il reperimento di elementi parassitari nel tratto digerente: da questo punto di vista è risultato fondamentale non frammentare le larve e/o gli adulti al momento dell'estrazione dallo spessore della parete del proventricolo, in quanto la rottura dell'estremità cefalica rende poi difficoltoso lo studio dei caratteri morfometrici all'esame microscopico e, di conseguenza, la possibilità di tipizzazione. Parallelamente, il mancato riscontro di uova nelle feci dei volatili esaminate potrebbe essere riconducibile al fatto che i campionamenti di guano sono stati effettuati in periodi in cui non c'è eliminazione parassitaria, o ce ne è in maniera molto blanda, da parte dell'ospite aviare. Da questo punto di vista, si renderanno pertanto necessari ulteriori campionamenti di feci di uccelli, al fine di proseguire la ricerca delle uova e poter quindi completare la definizione del ciclo biologico del parassita nel contesto lacustre esaminato.
Dal punto di vista di identificazione parassitaria, sulla base dei caratteri morfologici descritti tutti i nematodi campionati e riferiti preliminarmente al genere Eustrongylides sono risultati appartenere alla specie Eustrongylides excisus. Diversamente, non è stato possibile giungere ad una identificazione di specie degli stadi larvali provenienti da ospiti ittici a causa dall'assenza di caratteri morfologici sufficienti a giungere a tale livello tassonomico, come già evidenziato in passato da altri autori. Tuttavia, l'evidenza che il DNA delle larve fosse identico a quello degli adulti, identificati invece a livello di specie su base morfologica, ha comunque consentito di ascriverle alla specie E. excisus.
Quindi, tali risultati appaiono di estremo interesse poiché permetteranno in futuro di ottenere un'identificazione di specie anche per gli stadi larvali presenti negli ospiti intermedi e paratenici di Eustrongylides excisus, consentendo non solo di individuare i caratteri morfologici utili ad una identificazione tassonomica nelle fasi larvali, ma anche a definire il ciclo biologico e l'epidemiologia di questo parassita negli ecosistemi acquatici. Per quanto concerne le indagini sugli anellidi acquatici raccolti, in nessuno degli esemplari esaminati è stata individuata la presenza di stadi larvali di nematodi.
Va comunque evidenziato come le conoscenze attuali sulla identità degli anellidi primi ospiti intermedi di Eustrongylides sp. derivino quasi esclusivamente da prove di infezione sperimentali condotte su anellidi oligocheti della famiglia Tubificidae e Lumbriculidae, mentre sono ancora molto carenti dati sul ruolo di primi ospiti intermedi svolto dalle popolazioni di anellidi bentonici presenti negli ecosistemi acquatici interessati dalla parassitosi in ospiti ittici ed aviari.
I dati ottenuti consentono di poter dire che in Umbria il nematode Eustrongylides sp. rappresenta un parassita emergente nel lago Trasimeno, ad oggi limitatamente nelle specie ittiche (soprattutto persico e latterino) ed in uccelli ittiofagi (soprattutto cormorano e svasso) presenti nello stesso habitat. Non è stata invece finora dimostrata presenza in ospiti provenienti dal contesto del lago di Piediluco. La comparsa di questo parassita nella zona del Trasimeno è da ricercarsi nelle caratteristiche stesse del territorio, alla temperatura dell'acqua ed allo sviluppo delle uova. Sperimentalmente si è visto che lo sviluppo delle uova è massimo fra i 20°C e i 30°C, mentre temperature fra gli 0°C e i 15°C sono in grado di bloccarne la crescita (senza devitalizzarle). Senza dubbio il costante innalzamento delle temperature medie dovuto al surriscaldamento globale ("global warming") ha un ruolo nella biologia del parassita, soprattutto in un bacino idrico come quello del Trasimeno, molto esteso e poco profondo e quindi più soggetto a sbalzi termici.
Un altro importante fattore in grado di condizionare la presenza del parassita è la qualità dell'acqua. Le modificazioni chimicofisiche classiche dei bacini idrici antropizzati comprendono alterazioni fisiche del substrato, maggiore densità di oligocheti e pesci, diminuzione dell'ossigeno disciolto, aumento dell'azoto totale, aumento di fosforo e clorofilla nell'acqua superficiale, aumentato fabbisogno di ossigeno e fosforo nel sedimento con aumento delle dimensioni dei granuli che lo compongono e aumento di piante e arbusti "emergenti".
Tutte queste modificazioni sono dovute perlopiù ad un aumento di sostanze nutritive tramite l'immissione nel bacino idrico di acque piovane e rifiuti organici (come residui di cibo e soprattutto liquami), che sarebbero in grado di modificare drasticamente la numerosità e le abitudini alimentari delle popolazioni sia degli ospiti intermedi, che di quelli finali del parassita, facilitandone così la diffusione. Nel caso del Lago Trasimeno risulta difficile credere ad un aumento dell'inquinamento organico, data l'attenzione sempre maggiore che si pone a questo problema in Umbria e in tutta Italia, ed è quindi più plausibile che il fenomeno sia legato allo sversamento di acque piovane. É noto infatti che negli ultimi anni per scongiurare il rischio di prosciugamento del lago, soggetto ad una forte evaporazione nei mesi estivi (sempre a causa delle acque poco profonde e dell'estensione), si sia ricorsi ad un lavoro di canalizzazione, che ha portato le acque del lago, complici le forti piogge, a livelli mai registrati negli ultimi decenni.
Per quanto riguarda l'aspetto prettamente ispettivo e di sanità pubblica, l'Eustrongilidosi è chiaramente una zoonosi di tipo alimentare, in cui l'uomo riveste il ruolo di ospite accidentale. Ciononostante, le conseguenze dell'ingestione di carni crude di pesci parassitati da larve L4 possono essere molto gravi, passando da lievi sintomi gastroenterici fino alla perforazione intestinale con successiva peritonite. Si può dire che questa parassitosi, a livello clinico, ha molte analogie con l'Anisakiasi (è stata infatti definita anche "Anisakiasi d'acqua dolce") e le misure preventive e di sanificazione che è possibile adottare a livello di produzione e trasformazione del pesce sono pressoché sovrapponibili.
A livello di prevenzione diretta non è possibile fare molto, dato che i pesci parassitati sono difficilmente riconoscibili se non impossibili da identificare al momento della cattura. Eviscerare velocemente i pesci più piccoli per ridurre la migrazione delle larve nel tessuto muscolare è forse l'unica misura per cercare di prevenire la presenza del parassita nelle carni, anche se questa procedura è poco pratica se non impossibile da praticare in quelle specie che vengono consumate intere, come ad esempio il latterino. I normali processi di sanificazione riportati dalla normativa CE 853/2004 risultano invece essere più che sufficienti a garantire la sicurezza delle carni, dato che le larve del nematode non sopravvivono al congelamento a -20° C per 24 ore ne alla normale cottura (in cui si raggiungano almeno i 60°C al cuore della carne).
Nonostante tutto, a seguito dei primi casi di rinvenimento di nematodi Eustrongylides sp. nel lago Trasimeno ed alla sempre più consolidata usanza di consumare pesce crudo anche di lago, le Cooperative di pesca locali hanno introdotto, in via precauzionale, alcune misure per il contenimento del parassita in collaborazione con l'Assessorato alla Sanità della regione Umbria.
Risulta fondamentale quindi un controllo ispettivo visivo da parte del Veterinario ispettore e la stretta collaborazione di questo con gli operatori addetti alla trasformazione, che dovranno essere informati e formati allo scopo di eliminare e segnalare i prodotti parassitati. In questa fase le caratteristiche del parassita facilitano il lavoro di identificazione ed eliminazione, dato che questo già in forma L4 può raggiungere dimensioni consistenti e presenta una colorazione che varia dal rosa al rosso acceso.
Inoltre nei casi in cui sia presente una sola larva, la capacità del nematode di incapsularsi nel muscolo scheletrico può rendere sufficiente a risanare il filetto una semplice rimozione della sola parte parassitata (curettage).
L'aspetto così vistoso del parassita facilita senza dubbio il compito al Veterinario ispettore, rendendo improbabile che parti di muscolo parassitate possano arrivare fino al consumatore finale.
In un'ottica "one health", si può concludere che Eustrongylides sp. rappresenta in Umbria un problema da non sottovalutare, in quanto fenomeno emergente, in grado di arrecare danni economici ai produttori e potenzialmente pericoloso per la salute pubblica. Ulteriori indagini si renderanno necessarie al fine di fornire dati utili alla comprensione del ciclo biologico nella sua interezza e, di conseguenza, di acquisire migliori conoscenze circa epidemiologia della parassitosi.
Bibliografia
Anderson R.C., Chabaud A.G., Willmot S. (2009). Keys to the nematodes parasites of vertebrates. CAB International, Cambridge, USA.
Branciari R., Ranucci D., Miraglia D., Valiani A., Veronesi F., Urbani E., Lo Vaglio G., Pascucci L., Franceschini R. (2016). Occurrence of parasites of the genus Eustrongylides spp. (Nematoda: Dioctophymatidae) in fish caught in Trasimeno lake, Italy. Italian Journal of Food Safety, 5: 206-209.
Brinkhurst R.O., Jamieson B.G.M. (1971). Aquatic oligochaeta of the world. Oliver & Boyd, Edinsburgh, UK.
Cole R.A. (1999). Eustrongylidosis. Field manual of wildlife diseases: general field procedures and diseases of birds / Biological Resources Division: 223-228.
Dezfuli B.S., Manera M., Lorenzoni M., Pironi F., Shinn A.P., Giari L. (2015). Histopathology and the inflammatory response of European perch, Perca fluviatilis muscle infected with Eustrongylides spp. (Nematoda). Parasite & Vector, 8: 227-235.
Eberhard M.L., Hurwitz H., Sun A.M., Coletta D. (1989). Intestinal perforation caused by larval Eustrongylides (Nematoda: Dioctophymatoidae) in New Jersey. American Journal of Tropical Medicine and Hygiene, 40: 648-650.
Eberhard M.L., Ruiz-Tiben E. (2014). Case Report: cutaneous emergence of Eustrongylides in two persons from South Sudan. American Journal of Tropical Medicine and Hygiene, 90: 315-317.
Eiras J.C., Pavanelli G.C., Takemoto R.M., Nawa Y. (2018). An overview of fish borne nematodiases among returned travelers for recent 25 years unexpected diseases sometimes far away from the origin. Revista Mexicana de Biodiversidad, 89: 421-429.
El-Dakhly K.M., El-Nahass E., Uni S., Tuji H., Sakai H., Yanai T. (2012). Levels of infection of gastric nematodes in a flock of great cormorants (Phalacrocorax carbo) from Lake Biwa, Japan. Journal of Helminthology, 86: 54-63.
Goncharov S.L., Soroka N.M., Pashkevich I.Y., Dubovyi A.I., Bondar A.O. (2018). Infection of predatory fish with larvae of Eustrongylides excisus (Nematoda, Dioctophymatidae) in the Delta of the Dnipro River and the Dnipro Buh Estuary in Southern Ukraine. Vestnik Zoologii, 52: 137-144.
Gustinelli A. (2008). Elminti di interesse zoonosico in specie ittiche dulciacquicole nazionali. Tesi di Dottorato in Epidemiologia e Controllo delle Zoonosi (ciclo XX), settore VET-06, Alma Mater Studiorum Bologna, http://amsdottorato.unibo.it/816/2/Gustinelli_Tesi_Dottorato_Epidemiologia_e_controllo_delle_zoonosi__XX_ciclo.pdf
Karmanova E.M. (1968). Dioctophymidea of animals and man and diseases caused by them. Department of Agriculture and the National Science Foundation, Washington, D.C.: 103-206.
Cooper C.L., Crites J.L., Sprinkle Fastkie D.J. (1978). Population biology and behavior of larval Eustrongylides tubifex (Nematoda: Dioctophymatidae) in Poikilothermous Hosts. Journal of Parasitology, 64: 102-107.
Measures L.N. (1988a). The development and pathogenesis of Eustrongylides tubifex (Nematoda: Dioctophymatoidea) in piscivorous birds. Canadian Journal of Zoology, 66: 2223-2232.
Measures L.N. (1988b). Revision of the genus Eustrongylides Jagerskiold, 1909 (Nematoda: Dioctophymatoidea) of piscivorous birds. Canadian Journal of Zoology, 66: 885-895.
Measures L.N. (1988c). The development of Eustrongylides tubifex (Nematoda: Dioctophymatoidea) in oligochaetes. Journal of Parasitology, 74: 294-304.
Moszczynska A., Locke S.A., McLaughlin J.D., Marcogliese D.J., Crease T.J. (2009). Development of primers for the mitochondrial cytochrome c oxidase I gene in digenetic trematodes (Platyhelminthes) illustrates the challenge of barcoding parasitic helminths. Molecular Ecology Resources, 9: 75-82.
Paperna I. (1974). Hosts, distribution, and pathology of infections with larvae of Eustrongylides (Dioctophymidae, Nematoda) in fishes from East African lakes. Journal of Fish Biology, 6: 67-76.
Stocka I., Dziekoska Rynko J., Mierzejewska K., Staczak K., Wziatek B. (2017). Occurrence of Nematodes in the alimentary tract of great cormorants [Phalacrocorax carbo (Linnaeus, 1758)] in colonies located in the upper and lower Vistula River. Oceanological and Hydrobiological Studies, 46: 168-173.
Van Steenkiste N., Locke S.A., Castelin M., Marcogliese D.J., Abbott C. (2015). New primers for DNA barcoding of digeneans and cestodes (Platyhelminthes). Molecular Ecology Resources, 15: 945-952.
Xiong F., Wang G.T., Wu S.G., Nie P. (2009). Development of Eustrongylides ignotus (Nematoda: Dioctophmida) in domestic ducks (Anas platyrhynchos domestica (L.)). Journal of Parasitology, 95: 1035-1039.
Xiong F., Li W.X., Wu S.G., Zou H., Wang G.T. (2013). Molecular phylogeny and host specificity of the larval Eustrongylides (Nematoda: Dioctophymatidae) from freshwater fish in China. Journal of Parasitology, 99: 137-144.
Branciari R., Ranucci D., Miraglia D., Valiani A., Veronesi F., Urbani E., Lo Vaglio G., Pascucci L., Franceschini R. (2016). Occurrence of parasites of the genus Eustrongylides spp. (Nematoda: Dioctophymatidae) in fish caught in Trasimeno lake, Italy. Italian Journal of Food Safety, 5: 206-209.
Brinkhurst R.O., Jamieson B.G.M. (1971). Aquatic oligochaeta of the world. Oliver & Boyd, Edinsburgh, UK.
Cole R.A. (1999). Eustrongylidosis. Field manual of wildlife diseases: general field procedures and diseases of birds / Biological Resources Division: 223-228.
Dezfuli B.S., Manera M., Lorenzoni M., Pironi F., Shinn A.P., Giari L. (2015). Histopathology and the inflammatory response of European perch, Perca fluviatilis muscle infected with Eustrongylides spp. (Nematoda). Parasite & Vector, 8: 227-235.
Eberhard M.L., Hurwitz H., Sun A.M., Coletta D. (1989). Intestinal perforation caused by larval Eustrongylides (Nematoda: Dioctophymatoidae) in New Jersey. American Journal of Tropical Medicine and Hygiene, 40: 648-650.
Eberhard M.L., Ruiz-Tiben E. (2014). Case Report: cutaneous emergence of Eustrongylides in two persons from South Sudan. American Journal of Tropical Medicine and Hygiene, 90: 315-317.
Eiras J.C., Pavanelli G.C., Takemoto R.M., Nawa Y. (2018). An overview of fish borne nematodiases among returned travelers for recent 25 years unexpected diseases sometimes far away from the origin. Revista Mexicana de Biodiversidad, 89: 421-429.
El-Dakhly K.M., El-Nahass E., Uni S., Tuji H., Sakai H., Yanai T. (2012). Levels of infection of gastric nematodes in a flock of great cormorants (Phalacrocorax carbo) from Lake Biwa, Japan. Journal of Helminthology, 86: 54-63.
Goncharov S.L., Soroka N.M., Pashkevich I.Y., Dubovyi A.I., Bondar A.O. (2018). Infection of predatory fish with larvae of Eustrongylides excisus (Nematoda, Dioctophymatidae) in the Delta of the Dnipro River and the Dnipro Buh Estuary in Southern Ukraine. Vestnik Zoologii, 52: 137-144.
Gustinelli A. (2008). Elminti di interesse zoonosico in specie ittiche dulciacquicole nazionali. Tesi di Dottorato in Epidemiologia e Controllo delle Zoonosi (ciclo XX), settore VET-06, Alma Mater Studiorum Bologna, http://amsdottorato.unibo.it/816/2/Gustinelli_Tesi_Dottorato_Epidemiologia_e_controllo_delle_zoonosi__XX_ciclo.pdf
Karmanova E.M. (1968). Dioctophymidea of animals and man and diseases caused by them. Department of Agriculture and the National Science Foundation, Washington, D.C.: 103-206.
Cooper C.L., Crites J.L., Sprinkle Fastkie D.J. (1978). Population biology and behavior of larval Eustrongylides tubifex (Nematoda: Dioctophymatidae) in Poikilothermous Hosts. Journal of Parasitology, 64: 102-107.
Measures L.N. (1988a). The development and pathogenesis of Eustrongylides tubifex (Nematoda: Dioctophymatoidea) in piscivorous birds. Canadian Journal of Zoology, 66: 2223-2232.
Measures L.N. (1988b). Revision of the genus Eustrongylides Jagerskiold, 1909 (Nematoda: Dioctophymatoidea) of piscivorous birds. Canadian Journal of Zoology, 66: 885-895.
Measures L.N. (1988c). The development of Eustrongylides tubifex (Nematoda: Dioctophymatoidea) in oligochaetes. Journal of Parasitology, 74: 294-304.
Moszczynska A., Locke S.A., McLaughlin J.D., Marcogliese D.J., Crease T.J. (2009). Development of primers for the mitochondrial cytochrome c oxidase I gene in digenetic trematodes (Platyhelminthes) illustrates the challenge of barcoding parasitic helminths. Molecular Ecology Resources, 9: 75-82.
Paperna I. (1974). Hosts, distribution, and pathology of infections with larvae of Eustrongylides (Dioctophymidae, Nematoda) in fishes from East African lakes. Journal of Fish Biology, 6: 67-76.
Stocka I., Dziekoska Rynko J., Mierzejewska K., Staczak K., Wziatek B. (2017). Occurrence of Nematodes in the alimentary tract of great cormorants [Phalacrocorax carbo (Linnaeus, 1758)] in colonies located in the upper and lower Vistula River. Oceanological and Hydrobiological Studies, 46: 168-173.
Van Steenkiste N., Locke S.A., Castelin M., Marcogliese D.J., Abbott C. (2015). New primers for DNA barcoding of digeneans and cestodes (Platyhelminthes). Molecular Ecology Resources, 15: 945-952.
Xiong F., Wang G.T., Wu S.G., Nie P. (2009). Development of Eustrongylides ignotus (Nematoda: Dioctophmida) in domestic ducks (Anas platyrhynchos domestica (L.)). Journal of Parasitology, 95: 1035-1039.
Xiong F., Li W.X., Wu S.G., Zou H., Wang G.T. (2013). Molecular phylogeny and host specificity of the larval Eustrongylides (Nematoda: Dioctophymatidae) from freshwater fish in China. Journal of Parasitology, 99: 137-144.
| OPEN REVIEW - Modulo per la "revisione aperta" di questo articolo, pubblicato sul numero 114/2019 di SPVet.it |

Agnetti et al., 2019 - Studio sull'infestazione da Eustrongylides sp. (Nematoda: Dioctophymatidae) nei pesci lacustri: risultati della ricerca corrente izsum03/2015 (SPVet.it 114/2019)

Studio sull'infestazione da Eustrongylides sp. (Nematoda: Dioctophymatidae) nei pesci lacustri: risultati della ricerca corrente izsum03/2015 (SPVet.it 114/2019) by Agnetti et al., 2019 is licensed under a Creative Commons Attribution 4.0 International License.
Permissions beyond the scope of this license may be available at http://indice.spvet.it/adv.html.