Istituto Zooprofilattico Sperimentale dell'Umbria e delle Marche
Webzine Sanità Pubblica Veterinaria: Numero 97, Agosto 2016 [http://www.spvet.it/] ISSN 1592-1581
Documento reperibile all'indirizzo: http://spvet.it/indice-spv.html#633
Potenziale impiego dei fluidi orali per la diagnosi di peste suina classica
Potential use of oral fluids for the diagnosis of the Classical Swine Fever
Stefano Petrini, Ilaria Pierini, Cristina Casciari, Michela Pela, Monica Giammarioli, Francesco Feliziani, Gian Mario De Mia
Abstract. Classical swine fever (CSF) is a highly contagious disease, which may have significant economic impact. Reliable diagnostic methods are necessary in order to design optimized control strategies. The objective of this study was to evaluate the potential use of oral fluid as an alternative to serum samples for CSF diagnosis and its potential application in surveillance programs. For this purpose, individual oral fluid samples were collected at different post-infection days (PID) from eight pigs that were experimentally inoculated with a low dose of the CSF virus (CSFV) Alfort 187 strain. They were tested by ELISA and Virus neutralization (VN) for serology and by Real-time RT PCR for CSFV genome detection. The diagnostic results in oral fluids and in the corresponding blood samples were evaluated for correlation. There was no evidence of CSFV antibodies (ELISA, VN) in the swine oral fluid samples under our experimental conditions, therefore this potentially excludes CSF diagnosis based on serology of oral fluid. On the contrary, the antibodies were detected in VN and ELISA tests for the first time 10 and 15 PID, respectively and revealed until the end of the experiment.
In contrast, real-time RT-PCR could detect CSFV nucleic acid from the oral fluid as early as PID 8, which also coincided with the time of initial detection in blood samples. Notably, the probability of CSF detection in oral fluid was identical or even higher than that in the corresponding blood sample. Thus, our results support the feasibility of using this sampling method for CSFV genome detection, which may represent an additional cost-effective tool for CSF prevention and control
Riassunto. La peste suina classica (PSC) è una malattia altamente contagiosa, che ha un notevole impatto economico sull'industria suinicola. Per questo motivo sono necessari nuovi metodi diagnostici al fine di ottimizzare le strategie di controllo. L'obiettivo di questo studio è stato quello di valutare il potenziale impiego dei fluidi orali, come alternativa al prelievo ematico, per la diagnosi di PSC e la sua potenziale applicazione in programmi di sorveglianza. A questo scopo, da otto suini ibridi commerciali infettati sperimentalmente con il virus della PSC stipite Alfort 187, sono stati raccolti singoli campioni di fluidi orali, sangue e siero a diversi giorni post-infezione (GPI). Il materiale prelevato è stato utilizzato per allestire indagini sierologiche (ELISA, VN) e virologiche (Real-time RT PCR). I risultati ottenuti dai prelievi di saliva e dai corrispondenti campioni di sangue sono stati oggetto di un'analisi comparativa.
Nelle nostre condizioni sperimentali non è stata evidenziata la presenza di anticorpi (ELISA, VN) nei fluidi orali durante tutto l'esperimento, mentre gli stessi sono stati rilevati dal siero in VN ed ELISA per la prima volta rispettivamente dopo 10 e 15 GPI ed evidenziati poi fino al termine dell'esperimento.
I dati virologici hanno mostrato positività sia nella saliva sia nei corrispondenti campioni di sangue da 8 a 37 GPI. In particolare, la concentrazione del virus nei fluidi orali era pari o addirittura superiore a quella riscontrata nei sangue.
I risultati ottenuti in questo studio hanno evidenziano la possibilità di utilizzare i fluidi orali come metodo alternativo al prelievo ematico solo per il rilievo del genoma virale nell'ambito di programmi per la prevenzione e il controllo della PSC
Introduzione
I fluidi orali sono rappresentati da saliva e trasudato e originano dal sistema circolatorio. La composizione della saliva varia in base al tipo di ghiandola salivare interessata ed è costituita principalmente da acqua contenente molecole quali mucine, amilasi, lisozima, lipasi e glicoproteine. All'interno della cavità orale, la saliva esplica importanti funzioni quali: lubrificazione, attività antimicrobica, pulizia, formazione del bolo alimentare, masticazione, digestione, gusto, rimineralizzazione del dente e fonazione.
Inoltre la saliva contiene trasudato che attraversa la mucosa orale e la gengiva, dai capillari localizzati nella mucosa orale e gengivale. Il vantaggio dell'uso dei fluidi orali risiede nel fatto che sono facilmente prelevabili da personale con un minimo di training, eseguibile presso le proprie abitazioni dei pazienti, facili da processare e conservare (Chiappin et al., 2007).
Inoltre negli ultimi anni, i fluidi orali sono stati utilizzati per la ricerca di ormoni e per il rilievo di farmaci. Recentemente sono stati anche utilizzati per programmi di sorveglianza di diverse malattie infettive (HIV, Measles virus) in Africa, Tailandia, Europa e Brasile. In medicina veterinaria, le prime applicazioni dei fluidi orali risalgono al 1905 in Russia nel cavallo.
Nei suini, i primi lavori effettuati sono stati condotti da Corthier et al., (1976; 1977) per la ricerca di anticorpi nei fluidi orali a seguito di vaccinazione nei confronti del virus della peste suina classica (PSC). Successivamente i fluidi orali sono stati utilizzati in diversi studi per la ricerca di anticorpi nei confronti di E.coli (DeBuysscher et al., 1978), virus della gastroenterite trasmissibile (DeBuysscher et al., 1980), Actinobacillus pleuropneumoniae (Loftager et al., 1993), stomatite vescicolare (Stallknecht et al., 1999), afta epizootica (Eblé et al., 2004), sindrome respiratoria e riproduttiva del suino (Prickett et al., 2008a), circovirus suino tipo 2 (Prickett et al., 2008b, 2010), peste suina africana (Mur et al., 2013; Gimenez-Lirola et al., 2016).
I fluidi orali, si raccolgono facilmente da singoli animali o gruppi di suini dopo aver situato per 20-30 minuti in un box una corda di cotone e lasciata masticare da singoli suini o gruppi di animali.
Successivamente, dalla stessa, viene estratto il liquido contenente sieri e saliva ed inviato al laboratorio per le indagini dirette e indirette. Sulla base di quanto sopramenzionato e poiché ad oggi non esistono studi in merito all'uso dei fluidi orali per la diagnosi di PSC, il presente progetto di ricerca aveva come obiettivo quello di impiegare i fluidi orali per la diagnosi diretta e indiretta della PSC.
Materiali e Metodi
Per le prove sperimentali sono stati utilizzati n. 8 suini ibridi commerciali del peso di circa 10-15 kg. Gli animali sono stati alimentati due volte al giorno con mangime concentrato ed acqua ad libitum e stabulati presso l'unità di massima sicurezza (BSL-3) dell'Istituto Zooprofilattico Sperimentale dell'Umbria e delle Marche di Perugia, in box separati ognuno costituito da 2 animali.
Ciascun suino è stato inoculato per via intranasale con una dose di 103.00 TCID50 / 2 ml con il virus della peste suina classica (PSC) stipite Alfort 187 al 2° passaggio seriale su colture cellulari di rene di suino (PK-15).
Giornalmente gli animali sono stati sottoposti ad osservazioni cliniche e campioni di fluidi orali, sangue e siero sono stati prelevati da ciascun animale a 0, 3, 8, 10, 15, 17, 22, 24, 30, 37, 45 e 51 giorni post-infezione (GPI) per le indagini sierologiche e virologiche. I fluidi orali sono stati raccolti da ciascun animale usando una corda di cotone del diametro di 12 mm, lunga 25 cm appesa al centro del box e lasciata masticare per circa 10 minuti. Dopo tale periodo, la corda è stata strizzata e un volume di 3/5 ml di fluido orale è stato raccolto in un contenitore ad ogni prelievo.
I campioni sono stati saggiati in ELISA con il prodotto del commercio "IDEXX HerdCheck CSFV antibody ELISA test Kit" Classical swine Fever (CSF) antibody test kit (IDEXX®), ottimizzando il protocollo allegato allo stesso e analizzati con la prova di sieroneutralizzazione virale in accordo alla procedura descritta sul Manuale OIE ed. 6th 2008, Parte 2, Sezione 2.8, Capitolo 2.8.3.
Per quanto attiene alle indagini virologiche sono state allestite prove biomolecolari (Real-time RT PCR) sulla base della procedura descritta da Hoffman B. et al., (2005). I campioni che hanno mostrato un valore soglia (Ct) ≤ 42 sono stati considerati positivi, mentre quelli con un Ct ≥ 42 sono stati valutati come negativi.
Gli animali venuti a morte durante l'esperimento o soppressi al termine dello stesso, sono stati sottoposti ad esami anatomo-patologici.
I risultati ottenuti a partire dai fluidi orali e dai corrispondenti campioni di sangue sono stati oggetto di valutazione comparativa.
Risultati della ricerca
Le temperature rettali degli animali sono rimaste nei valori normali durante il periodo di acclimatamento. 8 GPI, 7 suini hanno evidenziato un rialzo febbrile tra 40°C e 41.4°C che è durato in media 6 giorni. 5 di questi hanno mostrato sintomi respiratori 7 GPI e gli stessi sono durati per 3 giorni. Inoltre da 2 animali è stata osservata costipazione seguita da diarrea, anoressia e letargia 14 GPI con una durata media di 1 giorno. Solo un suino ha mostrato segni clinici neurologici 8 GPI con un decorso di 1 giorno. Nessun soggetto ha mostrato lesioni cutanee.
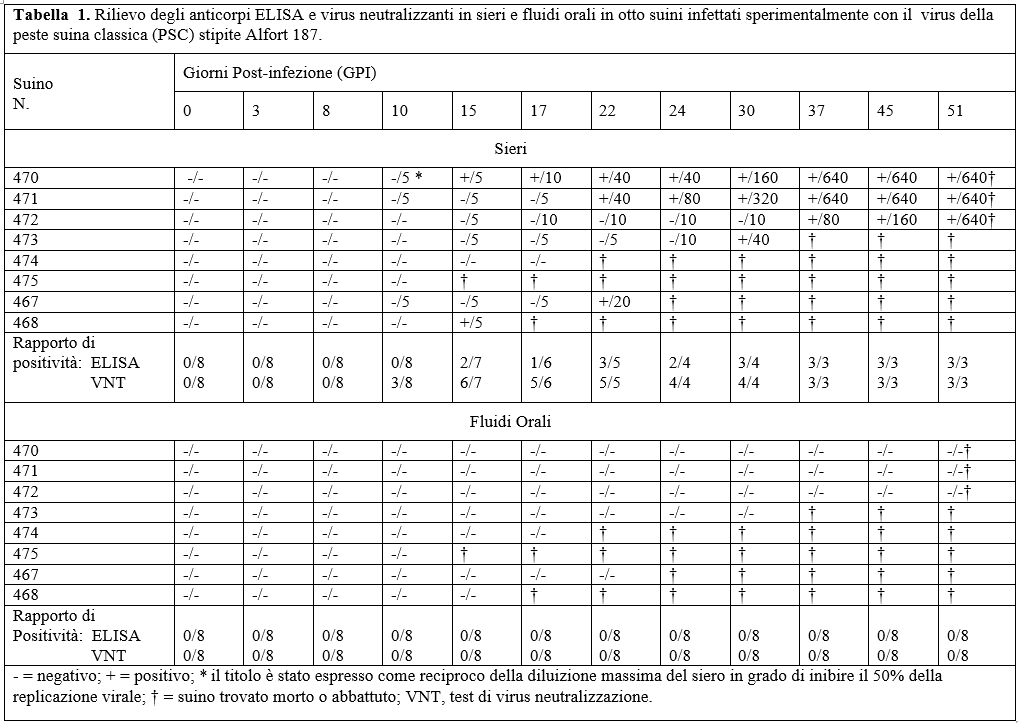
Anticorpi ELISA sono stati rilevati per la prima volta nel siero di 6 animali tra 15 e 37 GPI. Tre di questi suini sono risultati positivi fino al termine dell'esperimento. Gli anticorpi neutralizzanti sono stati rilevati per la prima volta nel siero di 6 suini tra 10 e 15 GPI con titoli medi di 1/5. Successivamente gli stessi, hanno sieroconvertito con titoli medi fino a 1/640. 2 animali sono deceduti rispettivamente a 15 e 22 GPI e non hanno prodotto anticorpi.
Per quanto riguarda la produzione di immunità umorale dai fluidi orali, nessun rilievo è stato accertato da tutti gli animali (Tabella 1).
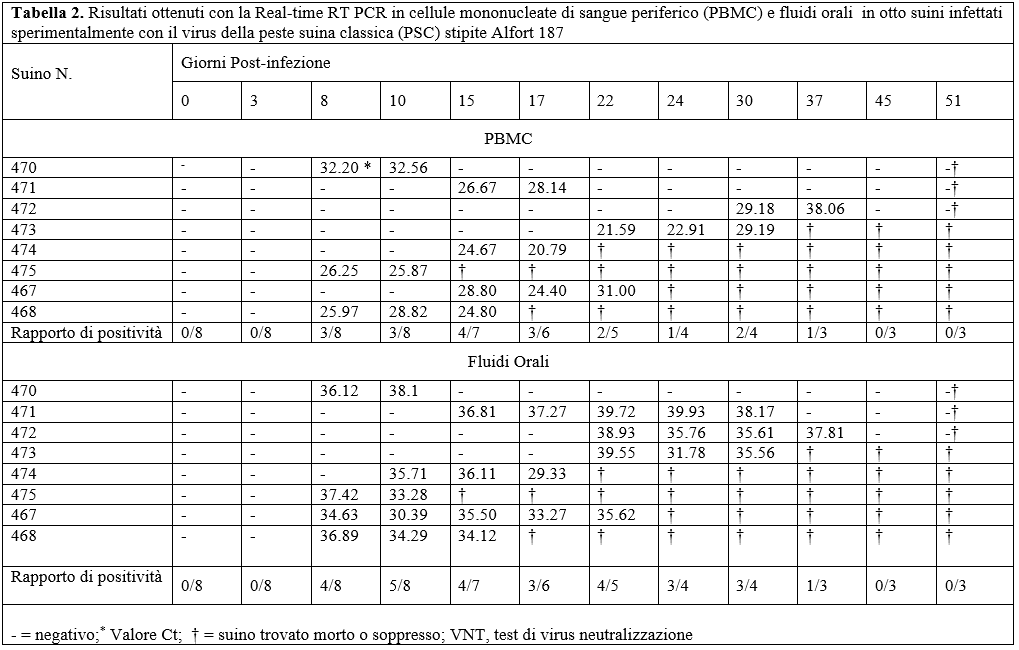
Dopo l'infezione sperimentale la prima positività virologica è stata rilevata sia dalle cellule mononucleate di sangue periferico (PBMC) che dai fluidi orali 8 GPI rispettivamente in 3 e 4 animali. I restanti suini sviluppavano viremia tra 10 e 22 GPI. Interessante notare che 3 campioni di fluidi orali erano positivi 5-8 giorni prima del corrispondente campione del sangue. Un fluido orale rimaneva positivo per 15 giorni post-infezione (15-30 GPI) con un alto valore di Ct (Tabella 2). In generale il Ct dei campioni di PBMC era inferiori rispetto a quelli dei fluidi orali e questo riflette un alto livello di viremia. Diversamente il rapporto di positività dei fluidi orali era maggiore (27/67= 0.40) rispetto a quello delle PBMC (19/67=0.28).
Gli esami necroscopici sono stati condotti su tutti gli animali. Durante l'esperimento sono deceduti 5 suini nelle ore notturne, da 11 a 35 GPI. I restanti animali sono stati abbattuti al termine dell'esperimento e da tutti i soggetti è stato possibile osservare lesioni macroscopiche riferibili alla peste suina classica.
Discussione e conclusioni
Negli ultimi anni i fluidi orali per la loro facilità di utilizzo e raccolta come alternativa al prelievo ematico, sono stati sempre più impiegati nell'ambito di programmi di sorveglianza di diverse malattie infettive (Mur et al., 2013, Prickett et al., 2008, Prickett et al., 2010, Olsen et al., 2013). L'obiettivo di questo studio è stato quello di comparare i risultati ottenuti dai fluidi orali con quelli del sangue a seguito di infezione sperimentale con il virus della peste suina classica su suidi domestici.
Depner et al., (1995) evidenziano che una dose di 300 TCID50/suino è sufficiente per infettare un animale con la PSC, ma nel nostro esperimento abbiamo ipotizzato di utilizzare 1000 TCID50/suino per infettare gli animali e farli siero-convertire.
I risultati di questa infezione sperimentale hanno evidenziato una sintomatologia clinica riferibile ad una forma moderata di peste suina classica in accordo ai risultati pubblicati da altri autori (Grau et al., 2015).
Per quanto attiene alla risposta immunitaria umorale circolante, la maggior parte degli animali ha prodotto anticorpi ELISA e virus neutralizzanti nei confronti della peste suina classica, mentre nessun movimento anticorpale è stato accertato nei fluidi orali durante tutto l'esperimento.
Questi risultati differiscono da quelli pubblicati da altri autori i quali hanno rilevato anticorpi nei fluidi orali in corso di influenza (Panyasing et al., 2014), afta (Eblé et al., 2004) e PRRS (Olsen et al., 2013).
Diversamente gli esami virologici (Real-time RT-PCR) hanno evidenziato una positività durante l'esperimento sia nei linfociti che nei fluidi orali da 8 a 37 GPI. I valori di Ct sono risultati maggiori nei fluidi orali rispetto al sangue. Risultati simili sono stati ottenuti in uno studio condotto da Grau et al., 2015, dove la viremia da PSC nei fluidi orali è stata accertata 5 GPI. Tali risultati contrastano quelli pubblicati in uno studio condotto da Mouchantat et al., 2014, dove cinghiali selvatici infettati sperimentalmente con uno stipite di PSC moderatamente virulento, hanno mostrato viremia nel sangue da 3 a 14 GPI, mentre nei fluidi orali è stata rilevata la viremia 12/13 GPI.
I risultati necroscopici ottenuti in questo studio sono simili a quelli pubblicati da Grau et al., 2015, mentre contrastano quelli originati da una ricerca effettuata da Mouchantat et al., 2014 dove non sono state rilevate lesioni riferibili a infezione da PSC.
In conclusione questo studio ha dimostrano che i fluidi orali possono essere utilizzati come metodo alternativo e non invasivo per rilevare la viremia da PSC nell'ambito dei programmi di controllo ed eradicazione nelle aree endemiche. Tuttavia dato che i fluidi orali non sono stati abili a rilevare anticorpi anti-PSC, studi successivi dovranno essere allestiti per incrementare la sensibilità dei metodi diagnostici applicati fino ad oggi.
Bibliografia
Chiappin S., Antonelli G., Gatti R., De Paolo F. (2007). Saliva specimen: A new laboratory tool for diagnostic and basic investigation. Clinica Chimica Acta 383: pag. 30-40.
Corthier G. (1976). Swine fever: influence of passive immunity on pig immune response following vaccination with a live virus vaccine (Thiverval strain). Annals of Veterinary Research 7: pag. 361-372.
Corthier G. and Aynaud J. (1977). Comparison of the immune response in serum and bucco-pharyngeal secretion following immunization by different routes with a long hog cholera virus vaccine (Thiverval strain). Annals of Veterinary Research 8: pag. 159-165.
DeBuysscher E. and Dubois R. (1978). Detection of IgA anti-Escherichia coli plasma cells in the intestine and salivary glands of pigs orally and locally infected with E.coli. Advances in Experimental Medicine and Biology 107: pag. 593-600.
DeBuysscher E. and Berman D. (1980). Secretory immune response in intestinal mucosa and salivary gland after the experimental infection of pigs with transmissible gastroenteritis virus. American Journal of Veterinary Research 41: pag. 1214-1220.
Depner K.R., Muller A., Gruber A., Rodriguez A., Bickhardt K., Liess B. (1995). Classical swine fever in wild boar (Sus scrofa) - experimental infections and viral persistence. Dtsch Tierarztl Wochenschr 102: pag. 381-384.
Eblé P., Bouma A., De Brun M., van Hemert-Kluitenberg F., Van Oirschot J., Dekker A. (2004). Vaccination of pigs two weeks before infection significantly reduces transmission of food-and-mouth diseases virus. Vaccine 22: pag. 1372-1378.
Grau F.R., Schroeder M.E., Mulhern E.L., McIntosh M.T., Bounpheng M.A. (2015). Detection of african swine fever, classical swine fever, and foot-and-mouth diseases viruses in swine oral fluids by multiplex reverse transcription real-time polymerase chain reaction. Journal of Veterinary Diagnostic Investigation 27(2): pag. 140-149.
Gimenez-Liroila L., Mur L., Rivera B., Mogler M., Sun Y., Lizano S., Goodel C., Harris Hank D.L., Roweland R.R., Gallardo C., Sanchez-Vizcaino J.M., Zimmerman J. (2016). Detection of African Swine Fever Virus Antibodies in serum and oral fluid speciments using a recombinant protein 30 (p30) dual matrix indirect ELISA. Plosone 9: pag. 1-14.
Hoffman B., Beer M., Schelp C., Schirrmeier H., Depner K. (2005). Validation of a Real Time RT-PCR assay for sensitive and specific detection of Classical Swine Fever. Journal of Virological Methods 130: pag. 36-44.
Loftager M., Eriksen L., Nielsen R. (1993). Antibodies against Actinobacillus pleuropneumoniae serotype 2 in mucosal secretion and sera of infected pigs as demonstrated by an enzyme-linked immunosorbent assay. Research in Veterinary Sciences 54: pag. 57-62.
Mouchantat S., Haas B., Bohle W., Globig A., Lange E., Mettenleiter C., Depner K. (2014). Proof of principle: Non-invasive sampling for early detection of foot-and-mouth diseases virus infection in wild boar using a rope-in-a-bait sampling technique. Veterinary Microbiology 172: pag. 329-333.
Mur L., Gallardo C., Soler Alejandro., Zimmerman J., Pelayo V., Nieto R., Sanchez-Vizcaino J.M., Arias M. (2013). Potential use of oral fluid samples for serological diagnosis of African swine fever. Veterinary Microbiology 165: pag. 165-139.
Olsen C., Karriker L., Wang C., Binjawadagi B., Renukaradhya G., Kittawornrat A., Lizano S., Coetzee J., Rodger M., Meiszberg A., Panyasing Y., Zimmerman J. (2013). Effect of collection material and sample processing on pig oral fluid testing results. The Veterinary Journal 198; pag. 158-163.
Panyasing Y., Goodell C., Kittawornrat A., Wang C., Levis I., Desfresne L., Rauh R., Gauger P.C., Zhang J., Lin X., Azeem S., Ghorbani-Nezami S., Yoon K-J., Zimmerman J. (2014). Influenza A virus surveillance based on pre-weaning piglet oral fluid samples. Transboundary and Emerging Diseases doi:10.1111/tbed.12307. pag. 1-11.
Prickett J., Simer R., Christopher-Hennings J., Yoon K-J., Evans RB Zimmermann J. (2008a). Detection of porcine reproductive and respiratory syndrome virus infection in porcine oral fluids samples: a longitudinal study under experimental conditions. Journal of Veterinary Diagnostic Investigations 20: pag. 156-163.
Prickett J., Simer R., Yoon K-J, Kim W-I and Zimmerman J. (2008b). Surveillance of commercial growing pigs for PRRSV and PCV2 infections using pen-based oral fluid samples. A pilot study. Journal of Swine Health and Production 16: pag. 86-91.
Prickett J., Cutler s., Kinyon J., Naberhaus N., Stenslad W., Yoo K.J., Zimmerman J.J. (2010). Stability of PRRSV diagnostic targets in swine oral fluids samples. Journal of Swine health and Production 18(4): pag. 187-195.
Stallknecht D., Howerth E., Reeves C., Seal B. (1999). Potential for contact and mechanical vector transmission of vesicular stomatitis virus New Jersey in pigs. American Journal of Veterinary Research 60: pag. 43-48.

S. Petrini et al. Potenziale impiego dei fluidi orali per la diagnosi di peste suina classica. (SPVet.it 97/2016)