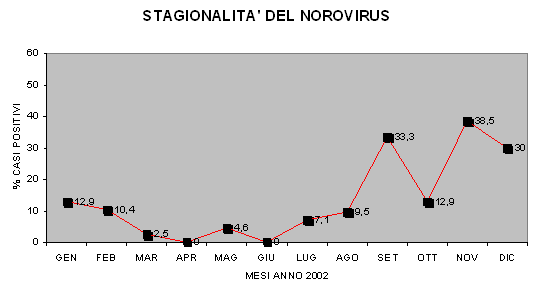
Grafico 1: Stagionalità del norovitìrus (Medici, M.C., et al. 2006)
| Tabella 1: Norovirus - Possibili vie di contaminazione. | |
| Via oro-fecale | - persona / persona - Alimenti - Acqua |
| Aerosol | - vomito - persona / persona |
| Contatto indiretto | - fomiti |

| Tabella 2: Comparazione dei vantaggi e svantaggi dei differenti metodi di estrazione di RNA (Roda de Husman, A. M., et al. 2007) | ||||
| Metodiche | Strumenti | Tempo | Materiali | Efficienza |
| Estrazione con silicio | Procedura "In-house" | 1.5 h | Incubatore Centrifuga-Eppendorf | Non diluito (segnale debole) |
| Qiashredder-estrazione con silicio | Combinazione kit commerciale con procedura "In-house" | 1.5h | Incubatore Centrifuga-Eppendorf | Non diluito (segnale debole) |
| RNeasy Mini Kit (Qiagen) | Kit disponibile in commercio | 30 min | Incubatore Centrifuga-Eppendorf | 10 - 4 |
| Ultracentrifuga- RNeasy Mini Kit (Qiagen) | Ultracentrifugazione combinata con kit commerciale | 2.5h | Ultracentrifuga Incubatore Centrifuga-Eppendorf | 10 - 4 |
| Cloroformio-PEG precipitazione | Procedura "In-house" | Circa 6 h | Centrifuga-Eppendorf Incubatore | 10 - 4 (segnale debole) |
| Tabella 3 Vantaggi e svantaggi dei vari metodi diagnostici | ||
| Metodo | Vantaggi | Limiti |
| Colture Cellulari | Incapacità di replicare su linee cellulari attualmente disponibili | |
| EM/IEM | Individuazione di tutti stipiti virali | -Costoso -Poco sensibile |
| ELISA | Praticità | -Individuazione solo alcuni
ceppi -Poco sensibile |
| RT-PCR | -Risultati in tempi rapidi -Sensibilità | -Numero campioni -Presenza di inibitori |
| Tabella 4: Numero di Focolai provocati da Norovirus dal 2002 al 2006 nei paesi che partecipano al progetto FBVE(Kroneman, A., et al. 2007) | ||||||
| Focolai per Paese e per anno | 2002 | 2003 | 2004 | 2005 | 2006 | tutti i focolai |
| Germania | 216 | 0 | 0 | 2019 | 3156 | 5391 |
| Spagna | 18 | 6 | 4 | 11 | 15 | 54 |
| Finlandia | 75 | 4 | 16 | 20 | 14 | 129 |
| Francia | 103 | 72 | 10 | 69 | 58 | 312 |
| Inghilterra | 795 | 219 | 301 | 357 | 221 | 1893 |
| Ungheria | 111 | 85 | 63 | 68 | 104 | 431 |
| Irlanda | 0 | 0 | 31 | 53 | 152 | 236 |
| Italia | 2 | 2 | 4 | 6 | 5 | 19 |
| Olanda | 150 | 52 | 124 | 93 | 219 | 638 |
| Norvegia | 0 | 0 | 0 | 25 | 29 | 54 |
| Svezia | 15 | 7 | 9 | 19 | 28 | 78 |
| Slovenia | 22 | 10 | 8 | 24 | 22 | 86 |
| Totale | 1523 | 464 | 592 | 2777 | 4074 | 9430 |
| Numero di città con focolai | 11 | 10 | 11 | 13 | 13 | |