Istituto Zooprofilattico Sperimentale dell'Umbria e delle Marche
Webzine Sanità Pubblica Veterinaria: Numero 52; Febbraio 2009 [http://www.spvet.it/] ISSN 1592-1581
Documento reperibile all'indirizzo: http://www.spvet.it/arretrati/numero-52/003.html
Determination of virulence of Streptococcus Suis biotype II, isolated in middle, south Italy - Determinazione dei fattori di virulenza di Streptococcus Suis biotipo II, isolati in Italia centro-settentrionale
Barocci S., Magistrali C., Ciuti F., Cucco L., Briscolini S., Nardi S., Simoni S., Sabbatini M.
Abstract. The Streptococcus Suis is considered one of the greater swine pathogens in intensive breeding condition in all the world.
The interest on this microorganism is due to the fact that it has caused serious illness in humans primarily in the Asiatic countries, but also in Europe several cases have been recorded. Thank to the Institute collection has been possible to study as much as 62 stocks of Streptococcus suis. Besides that, two additional strains, isolated by humans, have been analyzed. For the isolation and the identification, classical procedures, based respectively on mycro colture techniques and miniaturized systems have been used. After the optimization of the multiplex PCR, data obtained on the virulence have shown the prevalence of a recurrent profile in invasive bacteria strains isolated fron brain and spleen. Despite of the importance of infection sustained by S.suisas as emergent pathology in Italy, presently are missed adjourned works on epidemiologica characteristics and genetic profile of the coding sequences for the main factors of virulence.
Introduzione
Il genere Streptococcus è un gruppo eterogeneo di cocchi capsulati Gram positivi, che si dispongono in coppie o in catenelle, non formano endospore ed in genere non presentano mobilità. In particolare, lo S. suis è alfa-emolitico o non emolitico in agar sangue ed è normalmente sensibile in vitro alla penicillina (Prescott et al., 2005). I determinanti antigenici presenti nella parete cellulare ne permettono una specifica classificazione con il sistema di Lancefield, nei gruppi R, S e T. Questi gruppi, attualmente corrispondono rispettivamente ai seriotipi 2, 1 e 15.
Esistono differenti tipi di fattori di virulenza (Gottschalk et al., 2007). Fra questi, la capsula polisaccaridica sembra di importanza cruciale nella resistenza all'opsonofagocitosi. Sono stati trovati 35 seriotipi capsulari diversi, tuttavia, il sierotipo 2, sia esso virulento che non, è il più comune in tutto il mondo. L'assenza della capsula causa un aumento dell'idrofobicità del batterio e, di conseguenza, della fagocitosi, sia da parte dei macrofagi, che dei monociti. Quindi è stato concluso che i ceppi acapsulati risultano essere non virulenti (Gottschalk et al., 2000).
Il sierotipo 2 è quello maggiormente correlato a malattia, sia nel suino che nell'uomo, anche se sono stati ritrovati casi umani associati ai sierotipi 1 e 14 (Zhao et al., 2007).
Malattia nei suini
Lo Streptococcus suis è un microrganismo ubiquitario, esso può adattarsi a suini domestici e occasionalmente può essere ritrovato in cinghiali, cavalli, cani e gatti. L'infezione può anche essere asintomatica, quindi i soggetti che fungono da carrier, possono rappresentare un serbatoio di infezione, sia per l'allevamento, che per l'uomo.
L'habitat naturale dello S. suis è il tratto respiratorio superiore, in particolare le tonsille e le cavità nasali, più i genitali ed i tratti alimentari per lo più dei suini.
Attualmente lo S. suis è ritenuto uno dei più importanti agenti infettivi presenti negli allevamenti dei suini, con notevole probabilità per l'allevatore di contrarre l'infezione. Lo S. suis causa con rapidità ed in modo fatale sepsi in suinetti, associata a meningiti, poliartrite, endocardite ed occasionalmente a polmonite.
Nelle femmine adulte di suino, invece, può provocare aborti. Le meningiti sono dovute alla capacità del batterio di migrare dalle tonsille dell'animale infetto, attraverso il normale flusso sanguigno, al sistema nervoso centrale, dove causano infiammazione e danni gravi più estesi (Sriskandan et al., 2006).
Antropozoonosi e STSS
La sindrome da shock tossico (STSS) viene generalmente sostenuta dagli streptococchi di gruppo A (GAS), come lo Streptococcus pyogenes. Al momento, le STSS causate dai streptococchi non-GAS sono riferite al gruppo B e al gruppo C. Le infezioni umane da S. suis sono state descritte particolarmente nei paesi asiatici (Tailandia, Hong Kong e Giappone), ma sono stati riscontrati casi anche in paesi europei come ad esempio in Olanda, Grecia, Francia, Germania, Croazia (Zhao et al., 2007).
In Italia il primo caso è stato descritto nel 1995. Nel 2007, a 13 anni di distanza, è stato riscontrato un secondo caso di meningite umana da S. suis nel Nord-Est Italia, diagnosticato e trattato presso l'ospedale S. Maria degli Angeli in Pordenone (Udine) (Camporese et al., 2007). Il soggetto in questione era un macellaio di 30 anni, che, al momento del ricovero ospedaliero, manifestava già da due giorni febbre elevata associata a brividi e cefalea.
Il primo sospetto fu meningite batterica da Streptococcus pneumoniae. Contrariamente alle previsioni, l'isolamento batteriologico e l'identificazione biochimica dimostrarono che il microrganismo in questione era lo S. suis biotipo II con un'identità del 99,8% all'Api Rapid ID 32 Strep System (Biomerieux). La modalità del contagio fu chiarita solo dopo aver visto delle piccole abrasioni sulle mani del paziente. Nel mese di novembre dello stesso anno fu identificato un secondo caso di meningite umana sostenuta da S. suis biotipo II nella provincia di Cagliari. Il soggetto in questione era un pensionato di 68 anni, che, al momento del ricovero ospedaliero, già da due giorni manifestava febbre elevata, mal di testa, nausea e malessere generale. Anche in questo caso, l'esame batteriologico del liquido cefalorachidiano mostrò una crescita di streptococchi ?-emolitici su Agar Sangue e l'identificazione e la sierotipizzazione identificarono un profilo riconducibile a S. suis di tipo II. La modalità di contagio fu alquanto dubbiosa.
Il paziente negò qualsiasi recente contatto occupazionale e/o occasionale con maiali ed altri animali, escludendo del tutto la possibilità di ingestione di carne suina cruda o poco cotta (Manzin et al., in press).
Fattori di virulenza
Una caratteristica particolare di questi patogeni consiste nella diversità dei sierotipi. Tale diversità è dovuta ai diversi antigeni presenti sulla capsula polisaccaridica. I loci genici cps sono responsabili della biosintesi degli antigeni capsulari polisaccaridici nei sierotipi 1, 2, 7, 9 e 14. Dai dati epidemiologici emerge che i sierotipi più invasivi sono 1, 2, 9, 14, 22, rispetto agli altri, mostrando una prevalenza in Europa centrale dei sierotipi 2 e 9.
Esistono diversi fattori di virulenza che vengono espressi da S. suis. Tra questi i più importanti sono: la proteina per il rilascio della muramidasi (Mrp), codificata dal gene mrp, il fattore extracellulare (EF), codificato dal gene epf, la tossina suilisina (emolisina tio-attivata), codificata dal gene sly, capace di penetrare nei tessuti profondi e mediare effetti citotossici e l'arginino deaminasi, codificata dal gene arcA, che sembra giochi un ruolo importante nella sopravvivenza del batterio nelle condizioni di stress (Silva et al., 2006).
Sono presenti anche altri componenti della superficie cellulare, quali fimbrie ed adesine, coinvolti anch'essi nei processi di virulenza. I ceppi EF positivi sono capaci di indurre meningoencefaliti e poliatriti in suini, mentre i ceppi EF negativi sono capaci di causare infezioni più leggere.
I fattori di virulenza EF positivi e MRP negativi, frequentemente associati al sierotipo 2 e isolati da casi di meningite suina, non sono causa di malattia quando inoculati in altri suini. Ciò suggerisce la presenza di altri fattori di virulenza sconosciuti o che al momento non vengono rilevati (Staats et al., 1997). A proposito del fattore EF, è stato visto che ci sono delle varianti; tali varianti, sono tuttora in fase di caratterizzazione (Silva et al., 2006).
Materiali e metodi
I campioni isolati dall'IZSUM ed utilizzati per il presente studio appartengono tutti al sierotipo 2, quindi ceppi potenzialmente infettanti per l'uomo.
Sono stati testati 62 ceppi, provenienti da casi di meningite, setticemia o polmonite nel suino o da tonsille, prelevati al macello da soggetti asintomatici, isolati in Italia centro-settentrionale dal 2002 al 2007. Tra questi ceppi sono presenti i due casi umani isolati a Cagliari e Udine nel 2007, precedentemente citati. Tutti i ceppi di S. suis impiegati, sia per le indagini microbiologiche che per le indagini bio-molecolari, provengono dalla ceppoteca interna dell'IZSUM.
PCR Mutiplex
Il presente protocollo di mPCR è stato modificato ed ottimizzato da un lavoro già pubblicato da Silva et al. 2006. Prima dell'utilizzo del protocollo è stato eseguito un controllo tramite BLAST per la verifica dei primer. I numeri di accesso di GenBank (http://www.ncbi.nlm.nih.gov) sono riportati nella tabella 1.
Estrazione ed amplificazione del DNA
Il protocollo seguito per l'estrazione del DNA è quello modificato per i Gram positivi del QIAamp® DNA Mini Kit (QIAGEN). I ceppi testati sono stati prima rivitalizzati in BHI (Brain Heart Infusion), ripassati in AS (Agar Sangue) e poi utilizzati per l'estrazione del DNA genomico. Gli estratti di DNA sono stati utilizzati, dopo ottimizzazione della PCR multiplex (vedi Risultati) per l'amplificazione delle sequenze relative ai principali fattori di virulenza di S. suis. L'amplificazione permette la rilevazione dei geni codificanti per i quattro principali fattori di virulenza presenti in S. suis: epf, mrp, sly ed arcA. Nella stessa PCR si amplifica una porzione del gene cps2, specifico di S. suis biotipo II, che rappresenta sia un controllo per la biotipizzazione, sia un quinto fattore di virulenza. Le varianti del gene epf sono state testate in PCR singola per tutti i campioni che hanno mostrato bande ad altezze variabili tra le 800 e 1200 bp.
Nella reazione, circa 20 ng di DNA, sono stati amplificati in una reazione di 50 µL di volume finale, contenenti buffer di PCR 1X (Promega, Madison, WI, USA), 3 mM MgCl2 (Promega, Madison, WI, USA), 300 µM di deossinucleotidi trifosfato, 0,05 µM dei primers epf, 0,06 µM dei primers cps2J, 0,03 µM dei primers sly, 0,05 µM dei primers mrp, 0,06 µM dei primers arcA e 0,04 U/µL di GoTaq (Promega, Madison, WI, USA). Controlli positivi e negativi di estrazione e di PCR sono stati amplificati assieme ai campioni in amplificatore Eppendorf Mastercycler Gradient (Epperdorf, Germany), con il seguente programma: denaturazione iniziale a 94°C per 2 minuti, 40 cicli a: 94°C per 1 minuto, 50°C per 1 minuto, 72°C per 1,5 minuti ed un'estensione finale a 72°C per 5 minuti.
| Fatt. di patog. | Gene | Acc. No. | Sequenza Primer | Prodotto |
| EF | epf | X71881 | 5'-CGC AGA CAA CGA AAG ATT GA-3'
5'-AAG AAT GTC TTT GGC GAT GG-3' | 744 bp |
| CPS2 | cps2J | AF118389 | 5'-TTT GTC GGG AGG GTT ACT TG-3'
5'-TTT GGA AGC GAT TCA TCT CC-3' | 498 bp |
| MRP | mrp | X64450 | 5'-ATT GCT CCA CAA GAG GAT GG-3'
5'-TGA GCT TTA CCT GAA GCG GT-3' | 188 bp |
| Tossina suilisina | sly | EU043374 | 5'-GCT TGA CTT ACG AGC CAC AA-3'
5'-CCG CGC AAT ACT GAT AAG C-3' | 248 bp |
| Arginino deiminasi | arcA | EU768886 | 5'-TGA TAT GGT TGC TGC TGG TC-3'
5'-GGA CTC GAG GAT AGC ATT GG-3' | 118 bp |
Tab. 1 - Sequenze primers utilizzati e numeri di accesso di GenBank
I prodotti di PCR sono stati caricati su gel d'agarosio al 2% in TBE 0,5X (Tris base 1 M, Acido borico 1M, EDTA 20 mM pH 8), con aggiunta di 5 µL di bromuro d'etidio (10 mg/ml). Come standard per i pesi molecolari è stato utilizzato il marker da 100 bp (New England BioLabs). L'acquisizione dell'immagine è stata effettuata attraverso GelDoc 2000 (Bio-Rad).
Risultati
La fase sperimentale del lavoro è iniziata con l'ottimizzazione del protocollo di PCR per ogni singolo gene. La prima prova di ottimizzazione dell'amplificazione ha avuto l'obiettivo di determinare la migliore temperatura di annealing (Ta) alla quale venivano amplificati in maniera più efficace tutti i fattori di patogenicità considerati; a tale scopo è stata sfruttata l'opzione "gradient" dell'amplificatore Mastercycler Eppendorf. La prima prova di messa a punto, è stata effettuata con la coppia di primers codificanti per il fattore arginino deaminasi (gene arcA).
Il blocco dell'amplificatore è stato impostato alle temperature comprese tra 48,1°C e 51,4°C. Nella figura 1 viene riportato l'esempio del gradient effettuato per gene arcA.
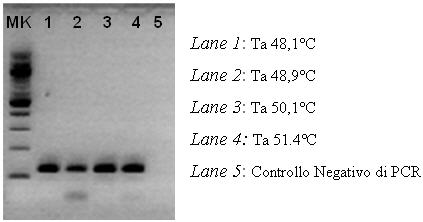
Fig. 1- Gel di agarosio del gradient per arcA (foto in negativo)
Lo stesso iter è stato seguito per tutti gli altri fattori di virulenza, mantenendo costante il gradient impostato. La Ta di 50,1°C è risultata la migliore per la PCR multiplex.
Per migliorare ulteriormente i risultati ottenuti dalla mPCR si è proceduto all'ottimizzazione della concentrazione di MgCl2 (portandolo da 2 mM a 3 mM).
Nella figura 2 viene riportata un'immagine del protocollo di mPCR per i cinque fattori di virulenza considerati.
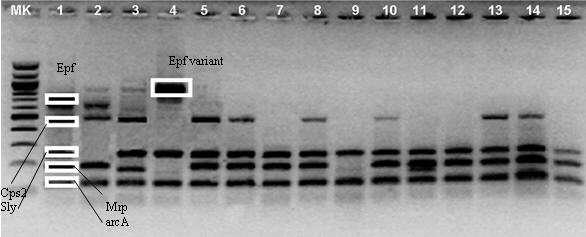
Fig. 2 - Gel di agarosio dell'amplificazione dei fattori di virulenza (foto in negativo).
MK: marker 100 bp; lane 1: campione positivo a tutti i fattori di virulenza; lane 4: campione con la variante di EF; lane 2-3 e 5-15: alcuni campioni della ceppoteca.
Di seguito viene riportata la distribuzione dei geni codificanti per i fattori di patogenicità, ritrovati durante il periodo compreso tra il 2003 e il 2007, in vari allevamenti centro-settentrionali italiani, in correlazione alla sede anatomica di isolamento.
| Origine | Epf | cps2 | sly | mrp | arcA |
| - | + | - | + | - | + | - | + | - | + |
Invasivi
(milza, cervello)
Polmone
Carrier
(Tonsille) | 15 | 20 | 13 | 22 | 0 | 35 | 2 | 33 | 0 | 35 |
| 15 | 7 | 13 | 9 | 5 | 17 | 5 | 17 | 0 | 22 |
| 3 | 0 | 2 | 1 | 1 | 2 | 2 | 1 | 0 | 3 |
| TOTALE | 33 | 27 | 28 | 32 | 6 | 54 | 9 | 51 | 0 | 60 |
Tab . 2 - Distribuzione dei fattori di patogenicità per i vari organi analizzati
In particolare, 22 sono stati isolati da cervello, 22 da polmone, 13 da milza e 3 da tonsille. In qualche caso, da un singolo allevamento, sono stati identificati e sottoposti ad analisi più isolati, appartenenti ad uno stesso evento epidemico, verificatosi in mesi o in anni diversi. Più dettagliatamente, 23 isolati provenivano dalla provincia di Perugia e di questi 10 sono stati isolati in diversi momenti epidemici da uno stesso allevamento. Gli allevamenti con isolati appartenenti alla provincia di Perugia sono stati in totale 8.
Il numero degli isolati provenienti dalla provincia di Ascoli Piceno sono stati in tutto 16 e provenivano da 5 aziende diverse. Anche in questo caso, da un unico allevamento sono stati identificati 10 isolati in anni diversi. Altri 10 isolati, sottoposti ad analisi, provenivano da allevamenti della provincia di Reggio Emilia; nei dati e tabelle seguenti sono stati considerati 60 campioni di S. suis isolati da suino.
I ceppi in questione, sono stati distinti in: 1) invasivi (cioè isolati da milza o cervello), 2) isolati da polmone e 3) carrier (tonsille prelevate al macello). Nella tabella 2 sono stati riportati i risultati per ogni singolo gene codificante per il relativo fattore di virulenza, in base all'origine dell'isolato.
Nella tabella 3, invece, sono mostrati i genotipi cumulativi codificanti per i fattori di virulenza, in base all'origine degli isolati. Ogni genotipo di virulenza è stato suddiviso a seconda della tipologia d'organo in esame. E' inoltre riportato il numero totale di genotipi ritrovati nelle diverse matrici. I dati mostrano numerosi stipiti positivi per il gene sly, mentre è stato riscontrato un 100% di positività per arcA.
| GENOTIPO | INVASIVI | POLMONE | TONSILLE | TOTALE |
| epf+/cps2+/sly+/mrp+/arcA+ | 19 | 5 | 0 | 24 |
| epf+/cps2-/sly+/mrp+/arcA+ | 1 | 0 | 0 | 1 |
| epf+/cps2-/sly+/mrp-/arcA+ | 0 | 2 | 0 | 2 |
| epf-/cps2+/sly+/mrp+/arcA+ | 3 | 3 | 1 | 7 |
| epf-/cps2+/sly-/mrp-/arcA+ | 0 | 1 | 0 | 1 |
| epf-/cps2-/sly+/mrp+/arcA+ | 10 | 6 | 0 | 16 |
| epf-/cps2-/sly+/mrp-/arcA+ | 2 | 0 | 1 | 3 |
| epf-/cps2-/sly+/mrp-/arcA+ | 1 | 0 | 0 | 1 |
| epf-/cps2-/sly-/mrp+/arcA+ | 0 | 2 | 0 | 2 |
| epf-/cps2-/sly-/mrp+/arcA+ | 0 | 1 | 0 | 1 |
| epf-/cps2-/sly-/mrp-/arcA+ | 0 | 1 | 1 | 2 |
| TOTALE | 36 | 21 | 3 | 60 |
Tab. 3 - Genotipi riscontrati nei vari organi analizzati.
Conclusioni
L'analisi degli isolati di Streptococcus suis ha permesso di identificare una notevole variabilità genetica di questo batterio. Questo dato è stato registrato in altri paesi europei e può essere ricondotto all'ampia diffusione di questo batterio (Vela et al., 2003). D'altra parte, è stata dimostrata la presenza di un clone di S. suis, dotato di particolari caratteristiche di virulenza (profilo epf+/cps2+/sly+/mrp+/arcA+), presente in 24 casi su un totale dei 60 ceppi isolati da suini utilizzati nel presente studio. Questo genotipo è stato ritrovato anche nei due ceppi di origine umana, dato interessante che può confermare l'origine zoonosica dell'infezione.
E' stato altrove osservato che ceppi di origine umana e suina tendono ad essere raggruppati in un medesimo cluster (Berthelot-Herault et al., 2002). L'analisi filogenetica dei suddetti campioni è stata effettuata mediante PFGE (Pulsed Field Gel Elecrophoresis), che ha permesso di evidenziare la presenza di 33 pulsotipi differenti; 22 dei ceppi esaminati appartengono ad un unico pulsotipo (genotipo di virulenza: epf+/cps2+/sly+/mrp+/arcA+), dimostrando quindi la prevalenza di un unico clone (Palmieri et al., submitted).
Dallo studio condotto sui geni codificanti per i fattori di virulenza appare evidente come gli stipiti associati alle forme di meningite e setticemia appartengano principalmente ai tre genotipi dominanti (epf+/cps2+/sly+/mrp+/arcA+, epf-/cps2+/sly+/mrp+/arcA+ ed epf-/cps2-/sly+/mrp+/arcA+), su un totale di 11 genotipi ritrovati. I ceppi appartenenti al sierotipo II e negativi al gene epf sono stati già ripetutamente isolati in Europa (Silva et al., 2006; Chatellier et al., 1999).
La presenza di ceppi cps2 negativi non stupisce, perché in Europa altri sierotipi, in particolare quello col profilo epf-/cps2-/sly+/mrp-/arcA+, si sono dimostrati in grado di provocare setticemia e meningite nel suino.
Inoltre, è stata dimostrata la presenza di un clone di S. suis dotato di particolari caratteristiche di virulenza, dal profilo epf-/cps2+/sly+/mrp+/arcA. Questo clone ha circolato in alcuni degli allevamenti esaminati per tutta la durata del periodo studiato (dal 2003 al 2007), continuando a provocare l'insorgenza di forme clinicamente manifeste, quali setticemia e meningite. Oltre che da un punto di vista temporale, ne è stata dimostrata la presenza in contesti territoriali diversi, essendo stato isolato in aziende appartenenti a diverse province e regioni a livello nazionale. Una situazione analoga è stata descritta anche in altri contesti geografici (Vela et al., 2003).
Il presente studio continuerà nella direzione di una maggiore comprensione dell'effetto dei fattori di virulenza. In particolare l'attenzione sarà rivolta al fattore EF, dal momento che diverse varianti sono state riscontrate nei campioni esaminati. Il primo passo sarà quello di eseguire una caratterizzazione molecolare del gene epf attraverso Restriction Fragment Length Polymorphism (RFLP) e sequenziamento dell'intero gene.
Bibliografia
1. Prescott L., Harley J., Klein D.2005. Microbiologia. Prima edizione Zanichelli.310-316.
2. Gottschalk, M. (2007) "Lessons learned from China's Streptococcus suis outbreak: risk for humans". In: Proceedings of the 38th American Association of Swine Veterinarians Annual Meeting, March 3-6 2007 Orlando, Florida:377-380.
3. Gottschalk M, Segura M. 2000. "The pathogenesis of the meningitis caused by Streptococcus suis : the unresolved questions". Vet Microbiol. 2000 Oct 1;76(3):259-72.
4. Zhao-RongLun, Qiao-Ping Wang, Xiao-Guang Chen, An-Xing Li, Xing-Quan Zhu "Streptococcus suis: an emerging zoonotic pathogen". Lancet Infect Dis 2007; 7:201-09.
5. Sriskandan S, Slater JD. "Invasive disease and toxic shock due to zoonotic Streptococcus suis: an emerging ...". PLoS Med. 2006 May;3(5):e187. Epub 2006 Apr 11.
6. Camporese A, Tizianel G, Bruschetta G, Cruciatti B, Pomes A. "Human meningitis caused by Streptococcus suis: the first case report from north-eastern Italy". Infez Med. 2007;15(2):111-114.
7. Manzin A., Palmieri C., Serra C., Saddi B., Princivalli M., Loi G., Angioni G., Tiddia F., Varaldo Pietro E., Facinelli B. "Streptococcus suis meningitis with no evidence of animal contact, Italy" Emerg Infect Dis. 2008 Dec;14(12):1946-8.
8. Luciana M.G. Silva, Crristoph G. Baums, Thomas Rehm, Henk J.Wisselink, Ralph Goethe, Peter Valentin-Weigand "Virulence-associated gene profiling of Streptococcus suis isolates by PCR". Veterinary Microbiology 115.2006.117-127.
9. Staats J.J., Feder I., Okwumabua O., Chengappa M.M. "Streptococcus suis: Past and Present"; Veterinary Research communications; 21 (1997) 381-407.
10. Vela A.I., Goyache J., Tarradas C., Luque I., Mateos A., Moreno M.A., Borge C., Perea J.A., Dominguez L., Fernandez-Garayzabal J.F. (2003) "Analysis of genetic diversity of Streptococcus suis clinical isolates from pigs in Spain by Pulsed-Field gel electrophoresis". J.Clin.Microbiol. 41, 2498-2502.
11. Berthelot-Herault F., Marois C., Gottschalk M., Kobisch M. (2002) "Genetic diversity of Streptococcus suis strains isolated from pigs and humans as revealed by pulsed-field gel electrophoresis". J.Clin.Microbiol. 40, 615-61.
12. Palmieri et al., submitted.
 Determination of virulence of Streptococcus Suis biotype II, isolated in middle, south Italy - Determinazione dei fattori di virulenza di Streptococcus Suis biotipo II, isolati in Italia centro-settentrionale
Determination of virulence of Streptococcus Suis biotype II, isolated in middle, south Italy - Determinazione dei fattori di virulenza di Streptococcus Suis biotipo II, isolati in Italia centro-settentrionale by
Barocci S., Magistrali C., Ciuti F., Cucco L., Briscolini S., Nardi S., Simoni S., Sabbatini M. is licensed under a
Creative Commons Attribuzione 2.5 Italia License.
Based on a work at
spvet.it.
Permissions beyond the scope of this license may be available at
http://indice.spvet.it/adv.html.



