Istituto Zooprofilattico Sperimentale dell'Umbria e delle Marche
Webzine Sanità Pubblica Veterinaria: Numero 53 Aprile 2009 [http://www.spvet.it/] ISSN 1592-1581
Documento reperibile all'indirizzo: http://spvet.it/arretrati/numero-53/mitic02.html
Surveillance activity in the IZS UM Food Safety lab of Ancona - Italy - Attività di sorveglianza nel laboratorio di sicurezza alimentare di Ancona dell'IZS UM
Sestili P., Santarelli S., Ottaviani D.
Abstract. This paper is the final report of the period of Voluntary Civil Service carried out at the Food Safety Laboratory, NRL for the bacteriological contamination of live bivalve molluscs.
Bivalve molluscs filtrate large volumes of water and are capable of retaining inside their body bacteria, viruses and chemical contaminants present in the marine environment.
For this characteristic they are both a perfect bioindicator of water quality and a possible source of gastro-intestinal diseases. Therefore, the hygienic-sanitary control is of fundamental importance.
This paper describes in details the enumeration of E. coli according to the ISO/TS 16649-3:2005 and the detection of Salmonella spp. according to ISO 6579:2004.
Il presente lavoro rappresenta l'elaborato finale redatto al termine del periodo di servizio civile volontario svolto nel Laboratorio di Sicurezza Alimentare, riconosciuto Laboratorio Nazionale di Riferimento per le contaminazioni batteriologice dei molluschi bivalvi vivi.
I molluschi bivalvi filtrano una grande quantità di acqua e possono trattenere nel loro organismo sia batteri, virus che contaminanti chimici eventualmente presenti nell'ambiente marino.
Per questa loro caratteristica, sono dei perfetti bioindicatori di qualità dell'acqua, ma anche i principali responsabili di malattie gastroenteriche. Quindi risulta di fondamentale importanza il controllo igienico-sanitario.
Viene descritta nel dettaglio la numerazione di E. coli, secondo, la norma ISO/TS 16649-3:2005, e la ricerca di Salmonella spp., secondo la ISO 6579:2004.
Introduzione
I molluschi bivalvi sono animali "scavatori sessili" che si nutrono di piccole particelle alimentari presenti nell'acqua o sul sedimento mediante un meccanismo di filtrazione ininterrotta.
A seconda delle dimensioni, della specie e della temperatura di stabulazione, i molluschi sono in grado di filtrare quantità variabili di acqua: un mitilo filtra a 14° C circa 1,5 litri di acqua l'ora, l'ostrica europea ne filtra 12 a 15° C, mentre quella americana supera i 18 litri a 20° C, per un totale di acqua filtrata che va da 36 a 432 litri al giorno.
Durante questa intensa attività di filtrazione i molluschi trattengono nel loro organismo non solo il plancton necessario al loro metabolismo, ma anche batteri, virus e contaminanti chimici eventualmente presenti nell'ambiente, concentrandoli fino a 100-200 volte.
La constatazione che i molluschi bivalvi vivi sono dei perfetti bioindicatori di qualità dell'ambiente marino ma anche i principali vettori di tossinfezioni alimentari, ha fatto sì che la Commissione Europea, nel Libro Bianco sulla Sicurezza Alimentare (2000), ponesse come strategica la questione del loro controllo igienico sanitario lungo l'intera filiera produttiva e commerciale.
Il ruolo svolto dai molluschi bivalvi nella trasmissione di alcune patologie umane è ormai noto da tempo e, già dall'inizio del secolo scorso, è cresciuta l'esigenza di un loro controllo microbiologico accurato. L' ambiente in cui essi vivono e crescono, le singolari modalità di nutrizione e alcune diffuse consuetudini nel consumo, ne hanno confermato l'importanza nella trasmissione all'uomo di malattie batteriche e virali in Italia e nel mondo.
A partire dagli anni '50 comunque, grazie al miglioramento delle tecniche per il trattamento delle acque di scarico e allo sviluppo di standard per la classificazione delle aree di allevamento e raccolta dei molluschi, l'incidenza di tali malattie, soprattutto febbre tifoide e colera, ha iniziato a declinare.
Ciononostante i molluschi non hanno smesso di costituire un problema per la salute umana: secondo i dati dei Centers for Disease Control and prevention (CDC), ad esempio, nel decennio 1978-1987, si sono verificate solo negli USA un totale di 128 epidemie gastroenteriche di vario tipo e 3747 casi associati al consumo di molluschi (National Advisory Committee on Microbiological Criteria for Foods, 1992).
È ragionevole comunque ritenere che i dati epidemiologici a disposizione siano sottostimati; in molti casi, infatti, il consumo di molluschi provoca solo sintomi gastrointestinali di lieve entità che non determinano il ricorso al sistema sanitario.
Il laboratorio di Sicurezza Alimentare di Ancona
Nel laboratorio di Sicurezza Alimentare di Ancona si svolgono analisi microbiologiche sui prodotti alimentari di origine animale e sui mangimi destinati all'alimentazione animale che vengono conferiti dai servizi veterinari delle zone territoriali dell' ASUR Marche, dai NAS, da aziende produttrici che devono effettuare l'autocontrollo.
Il Laboratorio di Sicurezza Alimentare inoltre, esegue il controllo ufficiale sui molluschi bivalvi provenienti da zone di produzione classificate (attività istituzionale).
L'autorità competente autorizza la raccolta dei molluschi bivalvi vivi in relazione alla provenienza ad una delle tre categorie di zone classificate secondo la contaminazione fecale (E. coli e Salmonella spp.) come previsto nell' Allegato II del Reg. CE 854/2004.
Allo scopo di testare la qualità del lavoro, l'abilità del personale tecnico e l'efficacia delle procedure, il laboratorio svolge periodicamente ring-test nell'ambito di due circuiti internazionali: FOOD EQA Shellfish scheme e QM: Quality in Microbiology Scheme.

Tabella 1. Carateristiche delle zone per destinazione e limiti analitici del prodotto

Tabella 2. Requisiti sanitari previsti dal Reg. CE 2073/2005 - Limiti microbiologici applicabili ai molluschi bivalvi
Escherichia coli, indice di contaminazione fecale
La necessità di ricercare organismi indice di contaminazione, la cui presenza potesse essere indice della presenza di patogeni nasce dalla difficoltà di utilizzare di routine tecniche finalizzate alla ricerca di tutti i possibili microrganismi patogeni per la definizione della qualità dell'alimento, dell'acqua o dell'ambiente.
Già nel 1850 con la scoperta di Snow e Budd della correlazione tra l'incidenza della febbre tifoide e la presenza di acqua contaminata, nasce l'esigenza di identificare "microrganismi indice" appropriati.
Nel 1880 von Fritch identifica la Klebsiella come indice di contaminazione umana per il controllo dell'acqua potabile. Nel 1885 Escherich descrive il Bacterium coli (che nel 1919 prenderà il nome di Escherichia coli) che sarà suggerito da Schardinger, nel 1892, come indice di inquinamento fecale. Nel 1914 il Sistema Sanitario degli Stati Uniti adotta come indice di qualità per l'acqua potabile, i Coliformi fecali.
Ma è nel 1977 che Ingram prima e Mossel poi propongono l'uso di batteri marker la cui ricerca informasse tanto sulla probabilità che il prodotto possa albergare germi patogeni quanto sull'efficacia del processo cui il prodotto è sottoposto.
Per quel che concerne gli organismi utilizzati quali marker di qualità è opportuno definire cosa si intende per organismo indice: secondo la definizione corrente "la presenza di un organismo indice in un alimento, in concentrazione superiore a determinati limiti, indica la possibile presenza di organismi patogeni ecologicamente correlati".
Tra gli indici di contaminazione più usati ci sono E. coli, la cui presenza in un alimento indica la fecalizzazione dello stesso e la possibile presenza di enterobatteri patogeni a habitat simile, e di Staphylococcus aureus.
In campo alimentare, la scelta di individuare organismi marker, è legata all'alto costo, alla necessità di laboratori attrezzati e personale altamente specializzato richiesti per la ricerca di tutti i potenziali patogeni; alla possibilità di risultati negativi anche quando tali patogeni sono presenti, causa il basso numero o causa una distribuzione non omogenea nell'alimento stesso.
Secondo la International Commission on Microbiological Specifications for Foods (ICMSF, 2003), un organismo marker deve godere di caratteristiche precise: deve essere simile al patogeno per ecologia, sopravvivenza, stabilità e caratteristiche di crescita, deve possedere caratteristiche biochimiche ben definite e identificabili, deve essere presente nell'alimento in quantità tale da non costituire problemi per la ricerca, deve avere un metodo per la determinazione e/o quantificazione facile, rapido, economico, sensibile, validato, non pericoloso per la salute dell'operatore e i risultati ottenuti devono essere applicabili al processo produttivo monitorato e devono mostrare correlazione tra la concentrazione dell'indicatore e il livello di pericolosità dell'organismo patogeno.
Echerichia coli, rappresenta un indice di contaminazione fecale più significativo e accurato rispetto ai microrganismi appartenenti al gruppo dei coliformi fecali. Infatti, se in questo gruppo sono comprese specie che possono anche non essere abituali ospiti dell'intestino, E. coli è invece una specie tassonomicamente ben definita, ospite del tratto intestinale degli animali a sangue caldo e dell'uomo e può, per questa sua caratteristica, costituire un indicatore fecale dotato di maggiore specificità.
Nei consideranda del Regolamento CE 2073/2005 della Commissione, del 15 novembre 2005, sui criteri microbiologici applicabili ai prodotti alimentari, si ricorda che il Comitato scientifico per le misure veterinarie in relazione con la salute pubblica (CSMVSP) il 19 e 20 settembre 2001 ha raccomandato l'utilizzo di E. coli piuttosto che dei coliformi fecali, come indicatori batterici per rilevare la contaminazione fecale nelle zone di raccolta dei frutti di mare.
La scelta di E. coli come indicatore primario è stata motivata dalla maggiore stabilità della sua presenza nell'ambiente acquatico nel corso dell'anno rispetto ai coliformi che risulterebbero, invece, più sensibili alle variazioni stagionali, e dalla minore sensibilità del microrganismo alle procedure di disinfezione rispetto ad alcuni patogeni enterici. Inoltre, va considerato che nell'ambito del gruppo dei coliformi, Escherichia coli è ampiamente rappresentato ed è in esclusivo rapporto con il tratto gastrointestinale dell'uomo e degli animali a sangue caldo, a differenza dei microrganismi di origine non necessariamente fecale, appartenenti ai generi Enterobacter, Klebsiella e Citrobacter che si caratterizzano anche per uno spiccato potenziale di ricrescita una volta pervenuti nell'ambiente.
Metodo per la numerazione di Escherichia coli
Il Reg 2073/2005 prevede al capitolo 1, punto 1.24, per la numerazione dell'E. coli nei molluschi bivalvi vivi, un prelievo di 1 n (n = unità campionarie che costituiscono il campione) che in questo caso rappresenta il campione aggregato costituito da 10 animali e come metodo di riferimento, la norma ISO/TS 16649-3:2005: "Microbiology of food and animal feeding stuffs. Horizontal method for the enumeration of beta-glucuronidase-positive Escherichia coli. Part 3: Most probable number technique using 5-bromo-4-chloro-3-indolyl-beta-D-glucuronide" (numerazione con la tecnica del Most Probable Number). Questa procedura, utilizzata nel laboratorio di Sicurezza Alimentare di Ancona, ha una maggiore affidabilità rispetto alla precedente, che prevedeva l'utilizzo del terreno A1, in quanto permette un miglior recupero del microrganismo target e presenta un limite di rilevabilità più basso corrispondente a 18 MPN/100g, anzichè a 180 MPN/100g.
Principio
La procedura tecnica si basa su due fasi operative distinte:
- Arricchimento selettivo: viene effettuato inoculando un terreno di coltura liquido di arricchimento selettivo con una quantità specificata della sospensione iniziale (10-1) e delle successive diluizioni decimali.
- Determinazione di E. coli β-glucoronidasi positivi: si effettua dalle provette di terreno di arricchimento selettivo risultate positive (produzione di acido) valutando l'attività β-glucuronidasica.
Preparazione del campione e sospensione iniziale
Per la preparazione del campione vengono seguite le indicazioni della ISO 6887-3.
I molluschi bivalvi dopo essere stati puliti e lavati con acqua corrente potabile, vengono scolati e coperti con carta assorbente.
Se sono presenti dei muscoli bissi, vengono tagliati con le forbici prima dell'apertura completa, poi vengono aperti sterilmente, solo quelli vivi, messi in busta sterile fino a raggiungere una quantità compresa tra 75 g e 100 g di polpa e liquido intervalvare. Il tutto viene omogenato in stomacher e vengono prelevati 10 g ± 5%, sempre in una busta sterile per stomacher. Successivamente vengono aggiunti due parti del diluente acqua peptonata tamponata e omogenati in stomacher per 60 secondi. Successivamente viene aggiunto il resto della quantità di diluente fino ad ottenere una diluizione 1+9 ovvero una sospensione iniziale alla concentrazione 10-1.
Arricchimento selettivo
Vengono allestite 3 serie di cinque provette contenente 10 ml di brodo MMGB (Minerals Modified Glutamate Broth). Le provette della prima serie con il terreno a doppia concentrazione, vengono inoculate con 10 ml della sospensione iniziale 10-1. Le provette della seconda e terza serie contenenti il brodo a concentrazione semplice, vengono inoculate rispettivamente con 1 ml della sospensione iniziale e 1 ml della diluizione 10-2 della sospensione iniziale.
Tutti i tubi vengono messi in incubazione a 37 ° C ± 1 °C per 24 h ± 2 h. Dalle provette che, dopo incubazione, mostrano una colorazione gialla del terreno (produzione di acido per fermentazione del lattosio), viene trasferita un'ansata su TBGA (Triptone Bile Glucuronide Agar) per ottenere colonie isolate. Le piastre vengono incubate a 44 °C ± 1 °C per 20-24 h.
La comparsa di colonie blu o blu-verdi indica la presenza di E. coli ?-glucuronidasi positivi.
Viene considerata positiva ogni provetta a doppia e a singola concentrazione che, subcoltivata su piastre di terreno selettivo, ha sviluppato colonie blu-verdi.
Interpretazione ed espressione dei risultati
Per risalire al Numero Più Probabile (MPN) di E. coli presenti in 100 g di alimento, vengono considerate le provette di MMGB confermate positive dalle piastre di TBGA per ciascuna diluizione. Viene assegnato il valore 1 ad ogni provetta positiva ed il valore 0 ad ogni provetta negativa sommando il valore delle cinque provette di ciascuna diluizione, si ottiene un numero di tre cifre. Da questo, tramite la tabella A1 (Norma ISO 7251:2005) si risale al valore di MPN.
Es.: n 3 provette positive alla diluizione 10-1 terreno a doppia concentrazione, n 2 provette positive alla diluizione 10-1 terreno a singola concentrazione e n 0 provette positive alla diluizione 10-2; il numero caratteristico sarà: 3 - 2 - 0. Leggere il corrispondente valore di MPN che in questo caso specifico risulta essere 1.4 MPN/g. Nei casi in cui il valore deve essere espresso come MPN/100g moltiplicare il valore ottenuto dalla tabella per 100.
Salmonella spp. come indice di Sicurezza Alimentare
La Salmonella è un bacillo Gram negativo, tipico della flora microbica intestinale dei vertebrati a sangue caldo e, di conseguenza, rientra nella cosiddetta microflora secondaria o alloctona del pescato. Poiché il principale serbatoio di diffusione nell'ambiente è sempre costituito dalle feci d'animali da allevamento e uomo, è verosimile che i prodotti della pesca possano inquinarsi con Salmonella spp. in due modi essenziali:
- per contatto con acque costiere, dolci o salmastre, in prossimità di foci di fiume o scarichi fognari;
- per inquinamento da manipolazione secondaria in fase di lavorazione (decapitazione, sfilettatura, ecc.), per inquinamento d'attrezzi di lavoro, superfici, ecc. non va dimenticato che a volte anche l'uomo può fungere da portatore asintomatico del microrganismo.
Salmonella è un patogeno noto come causa di tossinfezione a partire da alimenti quali, carni (di pollo, suino e bovino) e uova, nei prodotti ittici la presenza è aumentata da quando si è sviluppata l'importazione da paesi terzi, dove l'igiene di lavorazione è abbastanza scarsa.
I molluschi bivalvi vivi sono i prodotti della pesca più a rischio, seguiti da filetti di pesce e crostacei cotti sgusciati.
La prevenzione delle Salmonellosi da consumo di prodotti ittici si basa sul controllo della lavorazione nei paesi terzi e dei prodotti importati. A rischio i bivalvi allevati in prossimità di foci di fiumi di provenienza da zone altamente urbanizzate ed a vocazione zootecnica: controllo delle acque di produzione.
Sebbene la legislazione nazionale sia molto restrittiva riguardo la contaminazione da Salmonella, in quanto ne esige l'assenza in 25 g di prodotto, va considerato che non sempre la sua presenza è associata a malattia.
Dei circa 2400 sierotipi di Salmonella oggi identificati, S. enteritidis, S. tiphymurium, S. newport e S. heidelberg sono tra quelli maggiormente implicati nelle tossinfezioni alimentari.
Metodo per la ricerca di Salmonella spp.
Il Reg. 2073/2005 stabilisce che per la ricerca di Salmonella bisogna utilizzare la norma ISO 6579 "Microbiology of food and animal feeding stuffs - Horizontal method for the detection of Salmonella spp." che fornisce ai laboratori un metodo di riferimento per l'individuazione della presenza di Salmonella, per la definizione dei vari livelli di contaminazione da essa provocati e dei limiti di sicurezza relativi.
La norma, elaborata in seno all'ISO dalla Sottocommisisone 9 "Microbiologia" del comitato tecnico TC 34 "Prodotti alimentari", fornisce un metodo comune di ricerca per i laboratori a livello internazionale.
L'AOAC International (Association of Official Analytical Chemists International), grazie alle prove interlaboratorio effettuate negli Stati Uniti e in Europa e finanziate dalla Commissione Europea, ha approvato il contenuto della norma come "metodo ufficiale" di ricerca.
Considerando la varietà esistente di metodi di ricerca della Salmonella attualmente in uso nel mondo, la ISO 6579 dovrà assicurare l'armonizzazione di tali metodi mediante la comune accettazione dei risultati. Il documento è destinato ad essere utilizzato dai laboratori coinvolti nel controllo e nell'ispezione dei prodotti alimentari, dai laboratori dell'industria alimentare e delle bevande, pubblici e privati, impegnati nella ricerca della presenza di Salmonella.
Questa nuova edizione della ISO 6579 è stata adottata anche dal CEN - Comitato Europeo di Normazione - per fornire ai produttori, ai laboratori e alle autorità preposte, i vantaggi della norma internazionale comune.
Il regolamento CE 2073/05, indica per la ricerca di Salmonella di seguire la seguente impostazione- guida: un prelievo di 5 n (n = unità campionarie che costituiscono il campione); i limiti indicati sono assenza in 25 g in tutte le unità campionarie.
La ricerca di Salmonella necessita di quattro stadi successivi.
a) Preparazione del campione e prearricchimento
La procedura per la preparazione del campione è quella descritta dalla norma ISO 6887-3. Il prearricchimento prevede un campione di 25 g ± 5% l' aggiunta del diluente, che è sempre l'acqua peptonata tamponata (contenente però peptone di caseina) fino ad ottenere una sospensione 1:10. Quest'ultima viene incubata a 37 °C ± 1 °C per 18h ± 2h.
b) Arricchimento selettivo
Della coltura ottenuta vengono trasferiti 0,1 ml in una provetta contenente 10 ml di brodo RVS (Rappaport-Vassiliadis con Soia) e 1 ml in una provetta contenente 10 ml di brodo MKTTn (Mueller-Kauffmann tetrationato-novobiocina) precedentemente addizionato con 0,2 ml di soluzione iodio-ioduro e 0,1 ml della soluzione di novobiocina.
Il brodo RVS viene incubato a 41,5 °C ± 1 °C per 24h ± 3h, mentre il brodo MKTTn viene incubato a 37 °C ± 1 °C per 24h ± 3h.
c) Isolamento e identificazione
Dopo incubazione, dal brodo RVS viene presa un'ansata e strisciata su due piastre di terreno selettivo XLD (Xylose Lysine Deoxycholate Agar) al fine di ottenere colonie ben isolate. Tutto questo viene ripetuto per l'altro terreno Cromogeno selettivo.
Anche per il brodo MKTTn si effettua lo stesso procedimento.
Le piastre vengono incubate a 37 °C ± 1 °C per 24h ± 3h.
Le colonie tipiche di Salmonella su XLD si presentano con centro nero e una zona leggermente trasparente di colore rossiccio a causa del viraggio di colore dell'indicatore. Invece sul Cromogeno appaiono di color magenta.
d) Conferma
Per la conferma viene prelevata da ciascun terreno selettivo una colonia considerata tipica o sospetta. Esse vengono strisciate su Agar nutritivo semisolido, preparato in giornata, che consente lo sviluppo di colonie ben isolate. Le piastre vengono incubate a 37 °C ± 1 °C per 24h ± 3h. Da queste vengono eseguite le prove biochimiche e sierologiche.
Per la conferma biochimica possono essere utilizzati i kit di identificazione attualmente disponibili in commercio (rapid 20E).
Segue la conferma sierologica e tipizzazione del ceppo effettuate ricercando la presenza di antigeni O, Vi e H a partire da colonie pure e dopo eliminazione dei ceppi autoagglutinanti.
Nella tabella 3 è riportata l'interpretazione delle prove di conferma.
e) Conferma definitiva
I ceppi che sono ritenuti appartenenti al genere Salmonella, o che possono essere Salmonella (vedi tabella 3), vengono inviati al Centro di Riferimento regionale per la tipizzazione degli Enterobatteri presso la Sezione diagnostica di Macerata.
f) Espressione dei risultati
In conformità ai risultati dell'interpretazione, viene indicata la presenza o l'assenza di Salmonella in un'aliquota di prova di Xg o Xml di prodotto (ISO 7218).

Tabella 3. Interpretazione delle prove di conferma
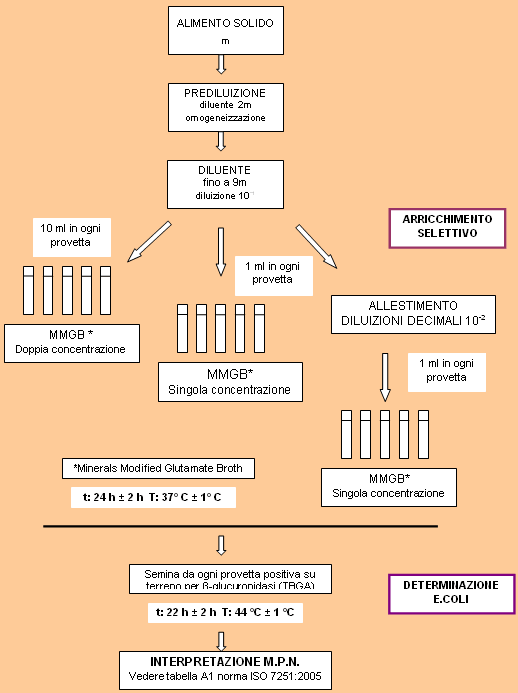
Figura 1. Rappresentazione schematica del procedimento per la conta di E. coli
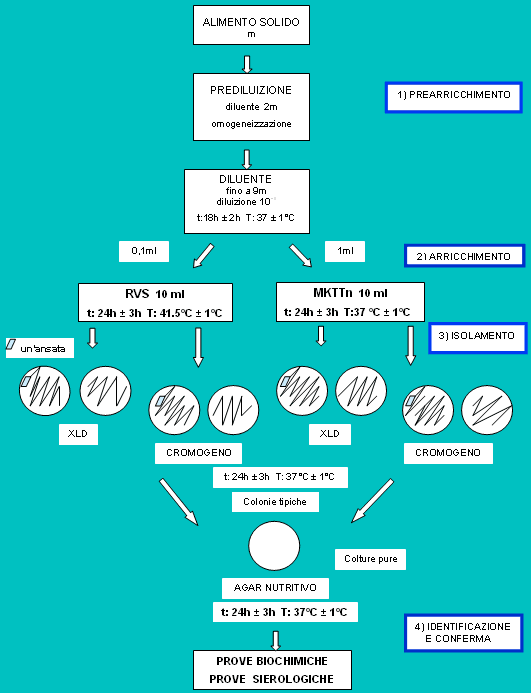
Figura 2. Rappresentazione schematica del procedimento per la ricerca di Salmonella spp
Considerazioni finali
L'esperienza di servizio civile nazionale è veramente formativa per tanti aspetti, uno dei quali è quello professionale perché si potrebbe definire come una "scuola del lavoro", in quanto permette di affiancare personale esperto ed imparare facendo. Si ha la possibilità di apprendere come si organizza il lavoro, i vari aspetti, le problematiche e come si cerca di risolverle. Inoltre si impara a stare in un ambiente di lavoro a seguire l'orario, a rispettare le persone e le cose.
E' una esperienza positiva anche perché aiuta la crescita del giovane, a maturare, a relazionarsi con gli altri, a lavorare in gruppo, a confrontarsi.
Non deve essere considerata come la perdita di un anno della propria esistenza ma come una delle tante esperienze che vanno a riempire la valigia che si porta nel cammino della vita.
BIBLIOGRAFIA
Alessi E., Croci L., (2005). Rapporti ISTISAN 05/04, 97-104.
Arcangeli G., Baldrati G., Pirazzoli P. (2003). In La trasformazione dei prodotti della pesca: tecnologia, controllo e igiene di lavorazione. Ed. SSICA , 287, 288.
ISO 6579:2004 "Microbiology of food and animal feeding stuffs - Horizontal method for the detection of Salmonella spp.".
ISO/TS 16649-3:2005 "Microbiology of food and animal feeding stuffs - Horizontal method for the enumeration of beta-glucuronidase-positive Escherichia coli - Part 3: Most probable number technique using 5-bromo-4-chloro-3-indolyl-beta-D-glucuronide".
ISO 6887-3:2003 "Microbiology of food and animal feeding stuffs - Preparation of test samples, initial suspension and decimal dilutions for microbiological examination - Part 3: Specific rules for the preparation of fish and fishery products".
ISO 7218:1996 "Microbiology of food and animal feeding stuffs - General rules for microbiological examinations".
REGOLAMENTO CE N. 2073/2005 DELLA COMMISSIONE del 15 novembre 2005 sui criteri microbiologici applicabili ai prodotti alimentari.
REGOLAMENTO CE N. 854/2004 DEL PARLAMENTO EUROPEOE DEL CONSIGLIO del 29 aprile 2004 che stabilisce norme specifiche per l'organizzazione di controlli ufficiali sui prodotti di origine animale destinati al consumo umano.






