Istituto Zooprofilattico Sperimentale dell'Umbria e delle Marche
Webzine Sanità Pubblica Veterinaria: Numero 64, Febbraio 2011 [http://www.spvet.it/] ISSN 1592-1581
Documento reperibile all'indirizzo: http://spvet.it/indice-spv.html#509
Tipizzazione genotipica e formazione di biofilm di ceppi di Listeria monocytogenes isolati nell'industria dei prodotti di gastronomia surgelati. Risultati preliminari - Genotypic typing and biofilm formation of Listeria monocytogenes strains in the industry of frozen food products. Preliminary results
Cecchini S., Palombo B., Briscolini S., Lanciotti M., Gattuso A., Gianfranceschi M.V., Loschi A.R., Blasi G.
Abstract. The purpose of this study is to report the preliminary data about the distribution of serotypes and pulsotypes of Listeria monocytogenes strains isolated from food and environmental samples in a processing plant of deep-frozen gastronomic preparations and identified by Multiplex-PCR and PFGE, respectively. The biofilm forming ability was also investigated using polystyrene microtiter plate assay with crystal violet staining. The strains identified by PFGE showed 11 different pulsotypes. The PCR showed that serotype 1/2b was the most representative (56%), followed by the serotype 1/2a (40 %) and serotype 1/2c (4%). All strains of L. monocytogenes tested were able to produce biofilm: the assay showed that 77,4 % of strains was strong biofilm producer (OD = 0,378), 16,1% moderate (OD = 0,193) and 6,5% weak (OD = 0,101).
Riassunto. Lo scopo del presente lavoro è quello di fornire dati preliminari sulla distribuzione di sierotipi e pulsotipi di ceppi di Listeria monocytogenes isolati da alimenti e ambiente di lavorazione di uno stabilimento che produce preparazioni gastronomiche surgelate, utilizzando la Multiplex-PCR e la PFGE. E' stata, inoltre, esaminata la capacità di formare biofilm in micro piastre di polystirene impiegando come colorante il cristalvioletto. I ceppi tipizzati mediante PFGE hanno mostrato 11 diversi profili; il sierotipo 1/2b è risultato essere il più rappresentativo (56%), seguito dal sierotipo 1/2a (40 %) e dal sierotipo 1/2c (4%). Tutte le colonie testate hanno prodotto biofilm: il 77,4 % dei ceppi si è mostrato forte produttore di biofilm (OD = 0,378), 16,1% moderato produttore di biofilm (OD = 0,193) e il 6,5% debole produttore (OD = 0,101).
Introduzione
Il "biofilm" è una matrice biologica attiva, adesa ad una superficie solida, costituita da batteri e matrice esopolisaccaridica extracellulare. La formazione di biofilm è un processo dinamico e complesso favorito all'interno di impianti industriali dal trasporto meccanizzato degli alimenti per il contatto tra superfici, molecole organiche e microrganismi: il progressivo accumulo di molecole sull'interfaccia liquido-solido determina una maggiore concentrazione di nutrienti favorendo la formazione di un film di "condizionamento" che altera alcune caratteristiche fisico-chimiche della superficie, quali idrofobicità e carica elettrostatica; inoltre la presenza di microscopiche soluzioni di continuità, anche in materiali come l'acciaio inox e la morbidezza di altri (teflon, gomma) favoriscono la ritenzione di cellule batteriche e materiale organico.
La presenza di biofilm suscita sempre maggiore interesse negli operatori del settore alimentare in quanto può essere la causa di problemi sanitari, oltre che di danni economici. Il periodico distacco di cellule batteriche dal biofilm rappresenta, infatti, una possibile fonte di contaminazione degli ambienti di lavoro e quindi degli alimenti da parte sia di germi alteranti che patogeni.
Il problema diventa particolarmente rilevante quando nel biofilm è presente anche Listeria monocytogenes, germe ubiquitario, frequentemente isolato dagli ambienti di lavorazione e veicolato dagli alimenti sia di origine animale che vegetale. E' noto che L. monocytogenes, una volta entrata all'interno di uno stabilimento risulta di difficile eradicazione per la notevole capacità di adattamento e di sopravvivenza anche in condizioni particolarmente difficili.
Numerosi fattori ambientali quali: temperatura, concentrazione di nutrienti (soprattutto zuccheri semplici, aminoacidi, PO4) (Moltz & Martin, 2005; Hanna & Wang, 2007), valori di pH, tipologia della superficie di contatto e differente risposta agli stress, per lo più ceppo specifica, possono influenzare la formazione e la quantità di biofilm prodotto da questo germe. La L. monocytogenes, a differenza di altri microrganismi, preferisce formare biofilm in presenza di alte concentrazioni di nutrienti (Stepanovic' et al., 2004). Alcuni autori hanno, anche, dimostrato un effetto sinergico sulla produzione di biofilm di glucosio e cloruro di sodio, addizionati a varie concentrazioni, e della temperatura (Pan Y. et al., 2010).
Molti fattori di virulenza, essenziali per l'adesione e l'invasione dei tessuti dell'ospite, sono proteine di superficie che rivestono un ruolo importante anche nell'adesione a superfici abiotiche. Studi recenti (Lemon et al., 2010) hanno evidenziato come il regolatore PrfA svolga un significativo impatto sulla produzione di biofilm nella L. monocytogenes, descrivendo come i ceppi mutanti non sono capaci di aderire alle superfici o comunque producono un biofilm "difettoso".
E' noto come la L. monocytogenes sia uno scarso produttore di biofilm se comparato ad altre specie microbiche (es: Salmonella spp., Enterococcus faecium, E. coli, Pseudomonas spp., ecc.), ma è anche risaputo che negli ambienti naturali è raro trovare biofilm formati da monocolture. Studi effettuati sulla produzione di biofilm da parte di ceppi differenti di L. monocytogenes mostrano capacità diverse legate al sierotipo e alla velocità di crescita (Pan et al., 2010). Inoltre altri studi hanno dimostrato che alcuni ceppi di Pseudomonas possono aumentare la colonizzazione di superfici inerti da parte della L. monocytogenes e/o proteggere questo patogeno dall'azione dei disinfettanti (Carpentier and Chassaing, 2004).
Scopo del presente lavoro è quello di presentare i primi risultati di una indagine volta a valutare il potenziale patogeno, determinare il sierotipo e il pulsotipo e definire la capacità di formazione di biofilm di ceppi di L. monocytogenes isolati da alimenti e ambiente di lavorazione di un'azienda alimentare di tipo industriale che produce surgelati pronti a cuocere (da consumarsi previa cottura). Il conoscere i meccanismi con cui si forma il biofilm e la tipizzazione genotipica mediante PFGE e PCR dei ceppi batterici patogeni capaci di sopravvivere nell'ambiente di lavorazione di aziende alimentari, può contribuire a tutelare il consumatore dalle zoonosi alimentari.
Materiali e metodi
Sono stati analizzati 71 campioni ambientali (superfici sporche e/o sanificate) e 16 campioni di alimenti (prodotti finiti, semilavorati, materie prime) raccolti presso uno stabilimento di tipo industriale, situato nell'Italia centrale che produce preparazioni gastronomiche panate surgelate pronte a cuocere a partire da vegetali di 2-3° gamma e prodotti di origine animale (carne e prodotti a base di carne, latte e prodotti lattiero caseari, ovoprodotto, prodotti a base di pesce), nel periodo maggio 2009 - maggio 2010.
Il controllo è stato effettuato nei momenti di più intensa produzione per tipologia e consistenza delle linee produttive allo scopo di raccogliere il maggior numero di ceppi batterici e monitorarne l'eventuale persistenza nell'ambiente. Sono stati individuati 25 diversi punti di campionamento ambientale, costituiti principalmente da piani di appoggio, contenitori di materie prime, semilavorati e prodotti finiti, nastri di trasporto in vari punti della linea di lavorazione, ruote, impianti frigoriferi, porte e parti di macchinari altamente specializzati a contatto con l'alimento (tritacarne, impastatrice, riempitrici, miscelatore pastella, pastellatrici, panatrici, tunnel surgelazione). In questa prima fase non sono stati considerati pareti, pavimenti, pozzetti di scarico e sistema di areazione. Sulla stessa attrezzatura sono stati valutati diversi punti di prelievo quando costruiti con materiali di differente tipologia (acciaio, teflon, plastica telata, gomma). Sulle parti dei macchinari risultate più frequentemente contaminate da L. monocytogenes il campionamento è stato ripetuto più volte nel corso dell'indagine.
Isolamento di Listeria monocytogenes
- campioni ambientali: il tampone o la spugna (sponge-bag) dopo essere stati strisciati sulla superficie da campionare sono stati posti in 5/100 ml di Buffered Peptone Water (BPW - Oxoid) rispettivamente e lasciati a temperatura di refrigerazione (4°C). Entro 24 h dal prelievo si è proceduto all' arricchimento in Half Fraser Broth (HFB - Oxoid) per 48 h a 30°C, al secondo arricchimento selettivo in Listeria Fraser Broth (FB - Biolife) per 48 h a 37°C. ed all'isolamento su Agar Listeria Ottaviani & Agosti (ALOA - Biolife) e Listeria Oxford Agar (Biolife) per 24 - 48 h a 37°C. Da ogni piastra sono state prelevate almeno 5 colonie sospette, seminate in Triptone Soya Agar
addizionato dello 0,6% di estratto di lievito (TASYE - Oxoid) ed incubate a 37°C per 24 h.
- alimenti: 25 g di prodotto sono stati omogeneizzati con 225 gr di diluente HFB, successivamente incubati a 30°C per 48 h. Le fasi successive al primo arricchimento sono sovrapponibili a quelle sopra descritte per i campioni ambientali.
I ceppi di Listeria spp. isolati sono stati sottoposti a prove di identificazione biochimica e morfologica di screening: Gram, catalasi, ossidasi, identificati mediante kit commerciali miniaturizzati (API Listeria - BioMérieux Italia Spa) e quindi stoccati in MicrobankTM a - 80°C per le successive valutazioni.
Per ulteriori indagini relative all'identificazione genotipica e alla produzione di biofilm, sono stati analizzati 2 ceppi per ogni campione risultato positivo. Inoltre, sono stati sottoposti ad ulteriori analisi altri 4 ceppi batterici isolati da prodotti finiti e materie prime, raccolti sempre nell'ambito della stessa azienda alimentare in un periodo precedente (2005-2006).
PCR per identificazione dei fattori di patogenicità
La PCR utilizzata nel presente studio ha previsto l'allestimento di 6 reazioni distinte in multiplex-PCR e single-PCR per effettuare l'identificazione genetica dei ceppi batterici e per definirne il profilo di patogenicità riferito ad 8 geni target. Il DNA estratto da ogni ceppo batterico mediante tecnica della bollitura, è stato successivamente amplificato utilizzando il Mastercycler Gradient (Eppendorf, Germany) secondo i seguenti protocolli:
1. single - PCR: gene hlyA della listeriolisinA O per l'identificazione batterica (Thomas et al., 1991);
2. single - PCR: gene actA della proteina actina (Jaradat et al., 2002);
3. single - PCR: gene iap della proteina p60 (Rawool et al., 2007);
4. single - PCR: gene plcA della fosfolipasi C (Rawool et al., 2007);
5. multiplex - PCR: geni prfA e plcB del "regolatore trascrizionale" PrfA e della fosfolipasi C rispettivamente (Rawool et al., 2007; Jaradat et al., 2002);
6. multiplex - PCR: geni inlA e inlB delle internaline A e B (Jaradat et al., 2002).
I prodotti della PCR (Tabella 1) sono stati caricati su gel di agarosio (1.5 %) e le bande, visualizzate al trans-illuminatore, sono state fotografate mediante UVsave Gel Documentation Sistem (UVITEC).
|
Tabella 1 - dimensioni dell'amplificato
|
| Gene Bersaglio |
Dimensioni
dell'amplificato (bp) |
| hlyA |
267 |
| actA |
268 - 385 |
| iap |
131 |
| plcA |
1484 |
| plcB |
261 |
| prfA |
1060 |
| inlA |
255 |
| inlB |
146 |
Sierotipizzazione mediante PCR multiplex
E' stata eseguita utilizzando i primers descritti nel lavoro pubblicato da Doumith et al. (2004) che permettono di separare i 4 maggiori sierotipi di L. monocytogenes (1/2a, 1/2b, 1/2c e 4b) in 4 gruppi distinti. La conferma dei sierotipi all'interno dei singoli sierogruppi è stata effettuata utilizzando la metodica della siero-agglutinazione.
Pulsed-Field Gel Electrophoresis (PFGE)
L'estrazione del DNA, la digestione dei campioni con l'enzima AscI e la PFGE per la determinazione del pulsotipo è stato utilizzato il Pulse-Net standardized protocol per L. monocytogenes (http://www.pulsenet-europe.org) modificato, mentre la preparazione del DNA ottenuto dal ceppo Salmonella ser. braenderup H9812, standard universale di peso molecolare caricato su ogni gel, è stata effettuata come descritto da Hunter et al. (2005). La corsa elettroforetica è stata eseguita utilizzando un sistema CHEF-DR III (Bio-Rad) ad un gradiente di 6 V/cm, angolo 120°, uno switch time di 4 - 40 secondi a 14 °C per 21 ore. Il gel è stato quindi colorato con etidio bromuro e l'immagine acquisita con l'UVsave Gel Documentation Sistem (UVITEC). Al fine di effettuare una quantificazione provvisoria del grado di correlazione tra i ceppi analizzati è stata individuata visivamente la presenza di profili identici o differenti per una o più bande; di fronte a profili con più di 10 bande è stato adottato il seguente schema di classificazione: nessuna differenza tra i profili: indistinguibili; da 2 a 3 bande diverse: strettamente correlati; da 4 a 6 bande diverse: possibilmente correlati; con 7 o più bande diverse: non correlati. In un secondo tempo è stata invece eseguita un'analisi più accurata mediante il software BioNumerics (Ver 4.0 Applied Maths) che elabora il dendrogramma mediante l'Underweight-Pair Group Matching Algorithm (UPGMA) a partire da una matrice di similarità ottenuta utilizzando il coefficiente di correlazione Dice, con limite di tolleranza e ottimizzazione dell'1,0 %.
Produzione biofilm
Per valutare la capacità di produrre biofilm da parte di ceppi di L. monocytogenes è stato utilizzato il protocollo descritto da Stepanovic et al. (2004) modificato in seguito ai risultati ottenuti da prove destinate a valutare l'influenza di alcuni parametri descritti in letteratura (Djordjevic et al., 2002; Borucki et al., 2003; Merritt et al., 2005; Harvey et al., 2007; Lemon et al., 2007; Stepanovic et al., 2007, Di Bonaventura et al., 2008). Le prove preliminari sono state realizzate utilizzando ceppi di riferimento forniti dall'IZS UM (Staphilococcus epidermidis RP62A - ATCC 35984; Enterococcus faecalis HC UD6), i quali hanno consentito di valutare (dati non riportati) l'influenza della concentrazione batterica iniziale utilizzata per l'inoculo; la temperatura ed i tempi di incubazione; la diversa tipologia di micropiastre, soluzioni coloranti sia reperibili in commercio di pronto uso che preparate ex-tempore (Figura 1).
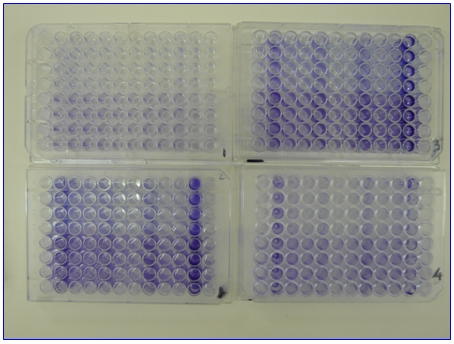
Figura 1 - Risultati di una prova preliminare sulla formazione del biofilm in micropiastre:
valutazione di 4 diverse tipologie di piastre disponibili in commercio e del colorante da utilizzare.
Legenda: 1- piastra per sierologia; 2/3/4 - piastre per colture cellulari; 4- piastra a fondo a U; nella metà destra di ciascuna piastra l'inoculo corrisponde a 1:12,5, mentre nella metà sinistra è di 1:5000; nella parte superiore di ciascuna piastra la colorazione è stata effettuata con Cristalvioletto (Merck), mentre nella parte inferiore è stato usato il Violetto di genziana (Carlo Erba). I pozzetti delle colonne 1-6-7-12 sono rappresentati dai controlli negativi (solo terreno di coltura- BHI), mentre nella colonna 2-11 e 5-8 sono stati inoculati rispettivamente Staphylococcus epidermidis RP62A - ATCC 35984 ed Enterococcus faecalis HC UD6 (controlli positivi) , nella posizione 3-10 e 4-9 L. monocytogenes e L. innocua rispettivamente.
Di seguito viene descritta la procedura utilizzata per l'identificazione dei ceppi produttori di biofilm: le L. monocytogenes (conservate a - 80°C) sono state rivitalizzate in piastre di TSAYE ed incubate a 30°C per 24h (working cultures); tali piastre sono state quindi conservate a + 4°C fino al momento dell'utilizzo (stock cultures); le colonie isolate sono state impiegate per allestire brodocolture overnight (18 h) in Brain Hearth Infusion (BHI - Oxoid), con le quali si è proceduto ad inoculare micropiastre sterili di polistirene a 96 pozzetti per colture cellulari non trattate (BD Falcon 351172) e subculture in TSA-YE.
Ogni ceppo di L. monocytogenes è stato saggiato in triplicato nella stessa micropiastra e l'esame ripetuto in tre sessioni svolte in giorni diversi; ogni pozzetto è stato riempito con 230 µl di BHI sterile e 20 µl di brodocoltura e; come controllo negativo è stato utilizzato il terreno sterile non inoculato (250 µl di BHI). Per evitare una eccessiva evaporazione del brodo anche i pozzetti periferici non utilizzati sono stati riempiti con terreno di coltura sterile.
Le piastre sono state quindi chiuse con l'apposito coperchio e incubate in aerobiosi per 48 h a 30°C.
Dopo il periodo di incubazione il contenuto delle piastre è stato rimosso per rovesciamento e i pozzetti lavati per 3 volte con acqua distillata sterile (300 µl); il biofilm presente nei pozzetti è stato quindi fissato con 250 µl di metanolo. Dopo 15 minuti le piastre sono state svuotate e lasciate asciugare all'aria.
Ogni pozzetto è stato colorato con 250 µl di cristal violetto (Gram's Crystalviolet solution, cod. 109218, Merck) per 5 minuti; l'eccesso di colorante è stato rimosso con acqua di fonte (300 µl per 3 volte) e successivamente le piastre sono state lasciate asciugare all'aria. Per la sospensione del colorante è stato utilizzato Ac. Acetico 33 % (v/v). La densità ottica di ogni pozzetto è stata misurata a 570 nm utilizzando il lettore spettrofotometrico Multiscan (LabSystem Ascent, Finlandia).
I dati ottenuti sono stati elaborati in un file Excel e, confrontando il valore della densità ottica O.D. ottenuto dalla media aritmetica dei 3 valori di ciascun ceppo con il valore di cut-off (ODc), definito come la media dei valori ottenuti dal controllo negativo addizionata di 3 volte la deviazione standard, è stata effettuata una classificazione dei ceppi come di seguito descritta:
- non produttore: Od ≤ ODc
- debole produttore: ODc < Od ≤ (2 x ODc)
- moderato produttore: (2 x ODc) < Od ≤ (4 x ODc)
- forte produttore: Od > (4 x ODc).
Risultati
Dei 71 campioni ambientali esaminati 26 sono risultati positivi per L. monocytogenes, con una percentuale del 23,4% per i tamponi e dell'11,3% per le spugne. Le attrezzature più contaminate sono risultate essere i piani di appoggio delle materie prime in acciaio, i nastri di trasporto in teflon, i nastri di trasporto in plastica telata e le ruote/piedini in teflon dei macchinari. L. monocytogenes è stata trovata anche su attrezzature sanificate (nastri di trasporto in teflon e contenitori in plastica). Per quanto attiene alla ricerca di L. monocytogenes negli alimenti, questa è stata riscontrata in 3 campioni, pari al 18,7%. In totale sono stati analizzati 62 ceppi batterici di L. monocytogenes.
I risultati dell'identificazione fenotipica si sono mostrati perfettamente rispondenti al profilo biochimico atteso, ad eccezione di alcuni ceppi debolmente emolitici, successivamente confermati come L. monocytogenes.
Tutti i ceppi batterici sono risultati positivi alla PCR per il gene hlyA confermando quindi l'appartenenza alla specie L. monocytogenes. I prodotti dell'amplificazione dei geni considerati sono risultati essere presenti e delle dimensioni attese. Soltanto due ceppi non hanno mostrato la presenza dei frammenti relativi a prfA e plcA. In accordo con altri autori (Rawool et al., 2007; Jaradat et al., 2002), l'amplificazione del gene actA ha dato amplificati di due dimensioni (97% amplicone di 385 bp e 3% amplicone di 268 bp) fatta eccezione per due ceppi che non hanno presentato, in un caso il frammento relativo a prfA e nell'altro quello relativo a plcA. Dei vari ceppi isolati si è scelto di effettuare la multiplex PCR e la siero-agglutinazione in 25 casi (un ceppo per campione), di questi il 56% è risultato appartenente al sierotipo 1/2b, il 40% al sierotipo 1/2a e il 4% al sierotipo 1/2c.
I ceppi batterici tipizzati finora hanno evidenziato profili di restrizione con un numero di bande compreso tra 8 e 12 (Figura 2); sono stati considerati uguali solo i ceppi con profilo di restrizione indistinguibile sia per numero che per posizione delle bande; ad oggi possiamo suddividerli in 11 pulsotipi.
Per quanto riguarda i risultati della PFGE l'indagine è ancora in corso, nella Figura 3 vengono riportati i dati dei 25 ceppi sierotipizzati.
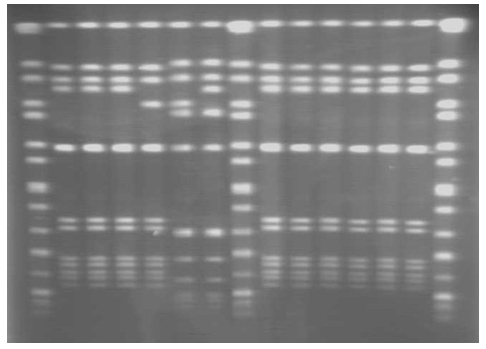
Figura 2: Pattern di restrizione di alcuni ceppi di
L. monocytogenes isolati e del controllo
(lane: 1 - 8 - 15
Salmonella ser. braenderup H9812)<
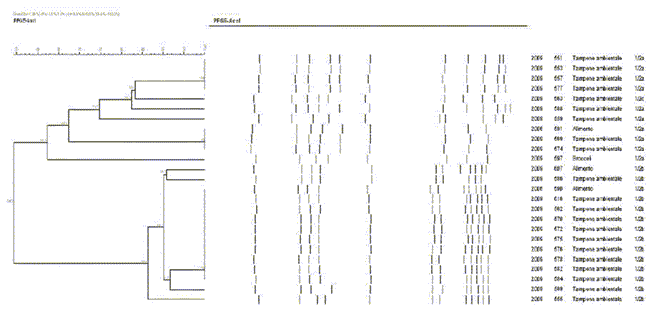
Figura 3 - Dendrogramma e sierotipizzazione dei ceppi isolati nel 2006 - 2009. [scaricare in formato pdf, 321 KB]
Produzione biofilm
Al momento sono stati saggiati 31 ceppi di L. monocytogenes e nelle condizioni di crescita utilizzate nella sperimentazione il 77,4 % si è comportato come un forte produttore (ODmedia = 0,378; ds = 0,037), il 16,1% come moderato produttore (ODmedia = 0,193; ds = 0,026) ed il 6,5% come debole produttore (ODmedia = 0,101; ds = 0,008) di biofilm. I risultati ottenuti sono riportati nelle Tabelle 2 e 3.
|
Tabella 2a - Produzione di biofilm: ceppi forti produttori
|
| Ceppo |
25 |
22 |
18 |
12 |
27 |
29 |
31 |
33 |
23 |
19 |
17 |
11 |
| OD |
0,492 |
0,421 |
0,422 |
0,412 |
0,435 |
0,419 |
0,463 |
0,466 |
0,485 |
0,458 |
0,430 |
0,489 |
| ds |
0,012 |
0,054 |
0,023 |
0,018 |
0,017 |
0,025 |
0,009 |
0,014 |
0,054 |
0,021 |
0,026 |
0,014 |
| OD |
0,354 |
0,364 |
0,385 |
0,396 |
0,350 |
0,362 |
0,396 |
0,431 |
0,369 |
0,397 |
0,350 |
0,377 |
| ds |
0,013 |
0,024 |
0,015 |
0,019 |
0,008 |
0,016 |
0,033 |
0,014 |
0,006 |
0,059 |
0,007 |
0,028 |
| OD |
0,333 |
0,407 |
0,366 |
0,336 |
0,325 |
0,302 |
0,334 |
0,366 |
0,395 |
0,346 |
0,348 |
0,439 |
| ds |
0,011 |
0,047 |
0,016 |
0,036 |
0,015 |
0,013 |
0,041 |
0,023 |
0,018 |
0,027 |
0,031 |
0,060 |
| MEDIA |
0,393 |
0,397 |
0,391 |
0,382 |
0,370 |
0,361 |
0,398 |
0,421 |
0,416 |
0,400 |
0,376 |
0,435 |
| ds |
0,086 |
0,030 |
0,029 |
0,040 |
0,058 |
0,059 |
0,064 |
0,051 |
0,061 |
0,056 |
0,047 |
0,056 |
|
Tabella 2b - Produzione di biofilm: ceppi forti produttori
|
| Ceppo |
7 |
3 |
1 |
42 |
24 |
36 |
43 |
37 |
34 |
28 |
30 |
32 |
| OD |
0,283 |
0,298 |
0,305 |
0,358 |
0,352 |
0,399 |
0,418 |
0,422 |
0,428 |
0,443 |
0,418 |
0,439 |
| ds |
0,032 |
0,021 |
0,025 |
0,021 |
0,033 |
0,031 |
0,015 |
0,029 |
0,034 |
0,019 |
0,034 |
0,033 |
| OD |
0,315 |
0,303 |
0,295 |
0,428 |
0,306 |
0,344 |
0,476 |
0,495 |
0,375 |
0,372 |
0,419 |
0,306 |
| ds |
0,022 |
0,038 |
0,025 |
0,030 |
0,030 |
0,020 |
0,029 |
0,058 |
0,014 |
0,020 |
0,049 |
0,022 |
| OD |
0,359 |
0,379 |
0,326 |
0,284 |
0,307 |
0,299 |
0,300 |
0,441 |
0,313 |
0,339 |
0,341 |
0,302 |
| ds |
0,019 |
0,038 |
0,027 |
0,005 |
0,007 |
0,020 |
0,017 |
0,049 |
0,036 |
0,024 |
0,015 |
0,029 |
| MEDIA |
0,319 |
0,326 |
0,309 |
0,357 |
0,322 |
0,347 |
0,398 |
0,453 |
0,372 |
0,385 |
0,393 |
0,349 |
| ds |
0,038 |
0,045 |
0,016 |
0,072 |
0,026 |
0,050 |
0,090 |
0,038 |
0,057 |
0,053 |
0,045 |
0,078 |
|
Tabella 3a - produzione di biofilm: ceppi deboli produttori
|
| Ceppo |
15 |
10 |
| OD |
0,127 |
0,110 |
| ds |
0,013 |
0,004 |
| OD |
0,099 |
0,097 |
| ds |
0,004 |
0,002 |
| OD |
0,095 |
0,079 |
| ds |
0,002 |
0,002 |
| MEDIA |
0,107 |
0,096 |
| ds |
0,018 |
0,016 |
|
Tabella 3b - produzione di biofilm: ceppi moderati produttori
|
| Ceppo |
21 |
4 |
2 |
26 |
38 |
| OD |
0,168 |
0,256 |
0,145 |
0,265 |
0,274 |
| ds |
0,015 |
0,012 |
0,006 |
0,008 |
0,017 |
| OD |
0,150 |
0,152 |
0,179 |
0,192 |
0,240 |
| ds |
0,006 |
0,007 |
0,016 |
0,008 |
0,003 |
| OD |
0,217 |
0,126 |
0,176 |
0,203 |
0,152 |
| ds |
0,017 |
0,002 |
0,019 |
0,008 |
0,012 |
| MEDIA |
0,178 |
0,178 |
0,167 |
0,220 |
0,222 |
| ds |
0,035 |
0,069 |
0,019 |
0,040 |
0,063 |
Considerazioni e conclusioni
I dati descritti nel presente lavoro hanno evidenziato che L. monocytogenes è presente anche in aziende che lavorano preparazioni gastronomiche panate e surgelate, come contaminante ambientale o negli alimenti, indipendentemente che quest'ultimi siano di origine animale o vegetale.
I ceppi saggiati si sono mostrati tutti biofilm produttori, anche se con valori moderati rispetto ad altre specie microbiche, in accordo con quanto descritto in letteratura (Stepanovic et al., 2004). Pertanto, ambienti che presentano condizioni favorenti lo sviluppo di biofilm batterici (presenza di nutrienti ed acqua, lunghi periodi di lavorazione), rischiano più di altri di essere colonizzati.
La stessa sanificazione pre-operativa risulta meno agevole rispetto ad altre tipologie aziendali per la presenza di macchinari con circuiti non smontabili, pompe di ricircolo di alimenti, snodi meccanici costruiti con materiali di diversa tipologia, ugelli; inoltre la presenza di fessure o "sporgenze" sui nastri di trasporto ostacola il normale "flusso" degli alimenti. Tutto ciò determina la possibilità che ceppi veicolati dalle materie prime possano divenire persistenti se non rimossi prima che avvenga l'irreversibile adesione alla superficie.
L'isolamento dello stesso pulsotipo dalle superfici durante la lavorazione e dopo sanificazione, il rinvenimento di ceppi con identici pattern di restrizione nella stessa superficie in giorni di campionamento diversi, confermano l'ipotesi che si possano creare vere e proprie nicchie ecologiche in grado di garantire la persistenza nell'ambiente di L. monocytogenes. I profili molecolari evidenziano, inoltre, che tutti i ceppi isolati possono essere considerati potenzialmente patogeni, fatta eccezione per due ceppi che non hanno presentato, in un caso il frammento relativo a prfA e nell'altro quello relativo a plcA; in particolare i sierotipi 1/2a e 1/2b risultano quelli di più frequente riscontro nei casi di listeriosi nell'uomo e, secondo alcuni autori, si isolano quasi esclusivamente negli alimenti di orine animale (Gianfranceschi et al., 2009).
I risultati, seppure ancora parziali, mostrano come in determinate realtà produttive sia necessario e fondamentale focalizzare l'attenzione sui prerequisiti strutturali sviluppando corretti schemi di progettazione dell'impianto, idonei protocolli di sanificazione nonché l'utilizzo di attrezzature facilmente smontabili e disinfettabili.
Bibliografia
Borucki M.K., Peppin J.D., White D., Loge F., Call D.R. (2003). Variation in biofilm formation among strains of Listeria monocytogenes. Appl Environ Microbiol., 69 (12), 7336-7342.
Carpentier B. Chassaing D. (2004). Interactions in biofilms between Listeria monocytogenes and resident microorganisms from food industry premises. Int. J. Food Microbiol., 97, 111-122.
Di Bonaventura F., Piccolomini R., Paludi D., D'orio V., Vergara A., Conter M., Ianieri A. (2008). Influence of temperature on biofilm formation by Listeria monocytogenes on various food-contact surfaces: relationship with motility and cell surface hydrophobicity. Journal of Applied Microbiology, 104, 1552-1561.
Djordjevic D., Wiedmann M., McLandsborough L.A. (2002). Microtiter plate assay for assessment of Listeria monocytogenes biofilm formation. Appl Environ Microbiol., 68 (6), 2950-2958.
Doumith M., Buchrieser C., Glaser P., Jacquet C., Martin P. (2004). Differentiation of the major Listeria monocytogenes serovars by multiplex PCR. J. Clin. Microbiol., 42 (8), 3819-3822.
Gianfranceschi M.V., D'Ottavio M.C., Gattuso A., Bela A., Aureli P. (2009). Distribution of serotypes and pulsotypes of Listeria monocytogenes from human, food and environmental isolates (Italy 2002-2005). Food Microbiology, 26, 520-526.
Hanna Scott E., Wang Hua H. (2007). Biofilm development by Listeria monocytogenes. In Biofilm in the food environment, Blackwell Publishing IFT press, 47-71.
Harvey J., Keenan K.P., Gilmour A. (2007). Assessing biofilm formation by Listeria monocytogenes strains. Food Microbiol., 24 (4), 380-392.
Hunter S.B., Vauterin P., Lambert-Fair M.A., Van Duyne M.S., Kubota K., Graves L., Wrigley D., Barrett T., Ribot E. (2005).
Establishment of a Universal Size Standard Strain for Use with the PulseNet Standardized Pulsed-Field Gel Electrophoresis Protocols: Converting the National Databases to the New Size Standard. J. Clin. Microbiol., 43 (3), 1045-1050.
Jaradat Z.W., Schutze G.E., Bhunia A.K. (2002). Genetic homogeneity among Listeria monocytogenes strains from infected patients and meat products from two geographic locations determined by phenotyping, ribotyping and PCR analysis of virulence genes. Int. Journ. of Food Microbiology, 76 (1-2), 1-10.
Lemon K.P., Higgins D.E., Kolter R. (2007). Flagellar motility is critical for Listeria monocytogenes biofilm formation. J Bacteriol., 189 (12), 4418-4424.
Lemon K.P., Freitag N.E., Kolter R. (2010). The virulence regulator Prfa promotes biofilm formation by Listeria monocytogenes. J. Bacteriol., 192 (15), 3969-3976.
Merritt J.H., Kadouri D.E., O'Toole G.A. (2005). Growing and analyzing static biofilms. Curr. Protoc. Microbiol., Chapter 1: Unit 1B.1.
Moltz A.G., Martin S.E. (2005). Formation of biofilms by Listeria monocytogenes under various growth conditions. J. Food Prot., 68 (1), 92-97.
Pan Y., Breidt F.Jr., Gorski L. (2010). Synergistic effects of sodium chloride, glucose, and temperature on biofilm formation by Listeria monocytogenes serotype 1/2a and 4b strains. Appl. Environ. Microbiol., 76 (5), 1433-1441.
Rawool D.B., Malik S.V., Shakuntala I., Sahare A.M., Barbuddhe S.B. (2007). Detection of multiple virulence-associated genes in Listeria monocytogenes isolated from bovine mastitis cases. Int. Journ. of Food Microbiology, 113 (2), 201-207.
Stepanovic S., Cirkovic I., Ranin L., Svabic-Vlahovic M. (2004). Biofilm formation by Salmonella spp. and Listeria monocytogenes on plastic surface. Lett Appl Microbiol., 38 (5), 428-432.
Stepanovic S., Vukovic D, Hola V., Di Bonaventura G, Djukic S., Cirkovic I., Ruzicka F. (2007). Quantification of biofilm in microtiter plates: overview of testing conditions and practical recommendations for assessment of biofilm production by staphylococci. APMIS, 115 (8), 891-899.
Thomas E.J., King R.K., Burchak J., Gannon V.P. (1991). Sensitive and Specific Detection of Listeria monocytogenes in Milk and Ground Beef with the Polymerase Chain Reaction. Appl. Environ. Microbiol., 57 (9), 2576 - 2580.




