Biblioteca Istituto Zooprofilattico Sperimentale dell'Umbria e delle Marche
Sanità Pubblica Veterinaria: Numero 70, Febbraio 2012 [http://www.spvet.it/] ISSN 1592-1581
Documento reperibile all'indirizzo: http://spvet.it/indice-spv.html#542
Consumo di pesce crudo e rischio anisakiasi - Consumption of raw fish and risk of anisakiasi
Abstract. In this paper the health problem linked to the consumption of seafood containing Anisakis and other parasites causes of zoonosis is discussed.
The widespread use of raw fish and the actual presence of parasites, requires the health service to carefully assess risks associated with such consumption.
Of course it is very important to spread, among consumers, basic information about the consequences of the ingestion of raw fish, the respect of basic hygiene practices and the habit of performing a thorough visual examination of the product.
All this in order to reduce the consumer exposure to zoonotic diseases from Anisakis, and similar organisms.
Riassunto. In questo articolo viene discusso il problema sanitario legato al consumo di prodotti ittici contenenti Anisakis ed altri parassiti causa di zoonosi.
Segnatamente in questi ultimi anni, la notevole diffusione del consumo di pesce crudo e la effettiva presenza di parassiti, impone al servizio sanitario di valutare attentamente i rischi legati a tali mode alimentari.
Altra attività auspicabile è la diffusione, fra i consumatori, di adatte informazioni sulle conseguenze del consumo di pesce crudo, sul rispetto delle pratiche igieniche fondamentali congiuntamente all'esame visivo del prodotto al fine di ridurre l'esposizone ai rischi di zoonosi sostenute da Anisakis e organismi consimili.
Introduzione
Il presente articolo desidera approfondire il problema igienico-sanitario legato all'eventuale presenza di Anisakis nel pesce, descrivendo l'approccio ispettivo e le adeguate misure di profilassi, anche alla luce della dilagante moda di consumare pesce crudo sia in ambito domestico che di ristorazione ("sushi", "sashimi", "surimi") e del costante rinvenimento in più specie ittiche di questo parassita.
Tra i parassiti causa di zoonosi, tre in particolare hanno suscitato l'interesse dell'opinione pubblica rendendosi più volte responsabili di forme cliniche accertate nell'uomo : Anisakis sp., Diphillobotrium latum ed Opistorchis felineus.
Anche i parassiti non zoonotici rivestono ugualmente un'importanza di tipo igienico-sanitario perché, localizzandosi spesso nel tessuto muscolare dei pesci, ne conferiscono un aspetto ripugnante ed incidono negativamente sulla qualità e sulle caratteristiche organolettiche del prodotto stesso.
|
Tabella 1 - Rappresentazione schematica delle più comuni parassitosi ittiche di interesse ispettivo
|
| Parassiti |
Parassiti zoonotici |
Parassiti non zoonotici |
| Cestodi |
Diphillobotrium latum, D. balenopterae, Diplogonoporus grandi , etc. |
Tripanorinchi: Gymnorynchus gigas, Nybelinia sp., Grillotia erinacei, Molicola horridus |
| Nematodi |
Anisakis sp., Contracecum sp., Pseudoterranova sp. |
Histerothylacium aduncum |
| Trematodi |
Opistorchis felineus, Clinostomum complanatum, Metagonimus sp., Heterophyes heterophyes |
Maccalumtrema xiphiados, Opecoeloides furcatus |
Anisakis
Nel nostro Paese vengono frequentemente segnalati numerosi casi di infestazione di varie specie ittiche da parte di larve di nematodi ascrivibili al genere Anisakis.
Il ciclo di sviluppo inizia con le uova emesse dalla femmina del parassita adulto che cadono in acqua insieme alle feci dell'ospite definitivo. Dopo circa 25 giorni e con una temperatura di circa 5-7°C, le uova si trasformano in forme larvali L1 e successivamente in L2.
Tali forme larvali vengono ingerite da piccoli crostacei eufasiacei o copepodi, primi ospiti intermedi. Quando un mollusco cefalopode o un pesce teleosteo (secondo ospite intermedio), ingerisce un crostaceo o un copepode, si ha il passaggio da L2 ad L3. Negli ospiti definitivi (balene, delfini, foche, etc.) si chiude il ciclo parassitario con lo stadio L4 e passaggio successivo alla forma adulta. L'uomo può infestarsi consumando un prodotto della pesca che contenga larve vitali in forma L3 ma, non essendo l'ospite definitivo, il parassita non può completare il proprio ciclo vitale.
Approccio ispettivo
Anisakis è facilmente visibile ad occhio nudo e si ritrova in forma incistata o libera, misurando da 1 a 3 cm, così come dimostrato nelle immagini sotto riportate in un esame necroscopico volto alla ricerca di dette larve in esemplare di Branzino o Spigola (Dicentrarchus labrax) e di Biso o Tombarello (Auxis thazard).
Come noto, dopo la morte dell'ospite la larva si trasferisce nel tessuto muscolare in tempi variabili e la velocità di realizzazione di tale fenomeno condiziona il grado di infestazione della muscolatura medesima.
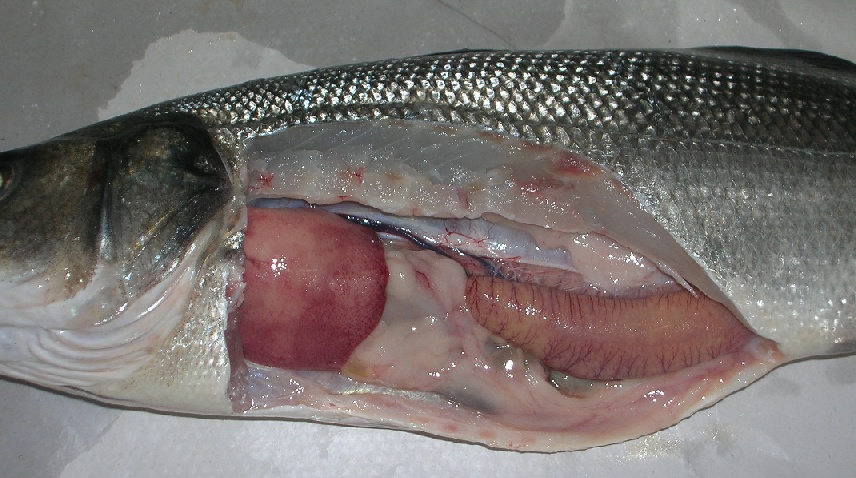
Foto 1, Esemplare di Dicentrarchus labrax
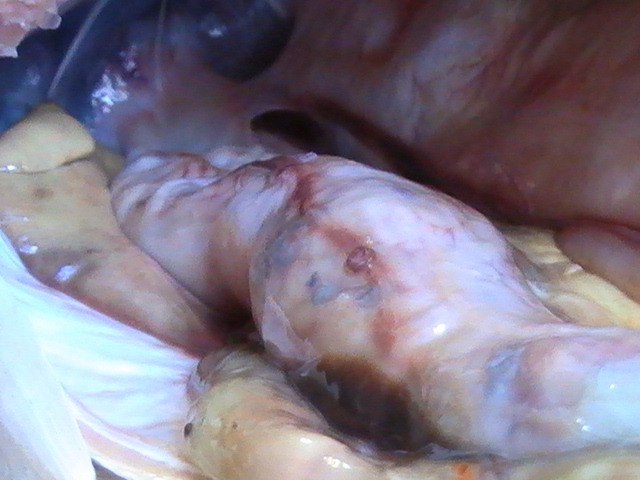
Foto 2, Parassita adagiato sulla sierosa gastrica
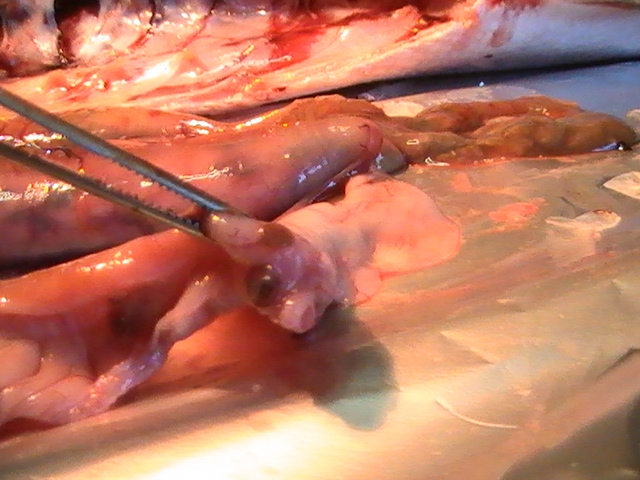
Foto 3, Forma incistata

Foto 4, Esemplare di Auxis thazard

Foto 5, Parassiti localizzati sulle gonadi
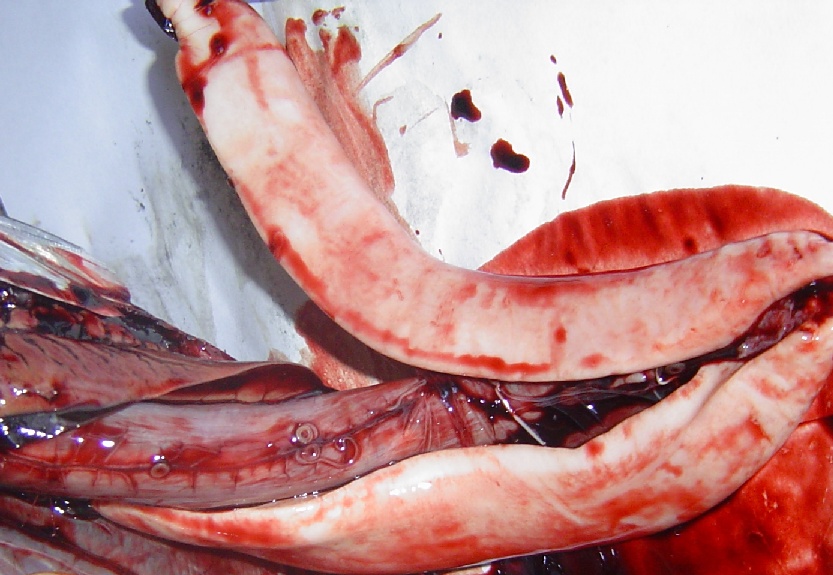
Foto 6, Parassiti adesi alla sierosa gastrica
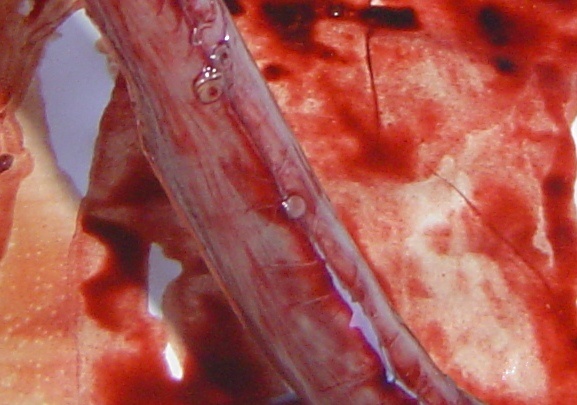
Foto 7, Parassiti adesi alla sierosa gastrica
Metodiche di ricerca di larve anisakidi nei pesci:
- Esame visivo
- Transilluminazione di piccoli frammenti di muscolo (max. 5 mm) o di filetti
- Digestione cloro-peptica di porzioni di muscolo (per esaminare pool).
Le seguenti tabelle possono rappresentare un valido aiuto per il veterinario ispettore al fine di effettuare una prima ricerca del parassita e la differenziazione macroscopica da altri Anisakidi quali Pseudoterranova ed Hysterothylacium.
|
Tabella 2 - Sede di principale localizzazione per specie ittica (maggior frequenza bibliografica di riscontro)
|
| Localizzazione |
Specie |
| Cavità celomatica |
pesce sciabola (Lepidopus caudatus), acciuga (Engraulis encrasicolus), sarda (Sardina pilchardus), aringa (Clupea harengus), suro (Trachurus trachurus), sgombro (Scomber scombrus), sarago sparaglione (Diplodus annularis) |
| Gonadi |
branzino (Dicentrarchus labrax), tombarello (Auxis rochei) , pesce san pietro (Zeus faber) |
| Fegato |
nasello (Merluccius merluccius), triglia di scoglio (Mullus surmuletus), potassolo (Micromesistius poutassou), acciuga (Engraulis encrasicolus) |
| Peritoneo |
pesce sciabola (Lepidopus caudatus), rana pescatrice(Lophius litulon), sgombro (Scomber scombrus), nasello (Merluccius merluccius), branzino (Dicentrarchus labrax) |
| Muscolo |
nasello (Merluccius merluccius), merlano (Merlangius maerlangus), scorfano (Scorpaena scrofa), triglia di scoglio (Mullus surmuletus) |
| Ciechi pilorici |
nasello (Merluccius merluccius), acciuga (Engraulis encrasicolus), sarda(Sardina pilchardus) |
|
Tabella 3 - Caratteristiche a confronto di: Anisakis, Pseudoterranova, Hysterothylacium
|
| Specie |
Misura |
Colore |
Posizione |
| Anisakis simplex |
18-36 mm lunghezza
0.3-0.7 mm larghezza |
Biancastro
|
Racchiusa "a spirale" |
| Pseudoterranova
dicipiens |
25-60 mm lunghezza
0.3-1.2 mm larghezza |
Giallastro / marrone- rossastro |
Distesa con forma a "S" o a "8" |
| Hysterothylacium aduncum |
18 - 21 mm lunghezza
0.3 - 0.5 larghezza |
Bianco - giallastro |
Atteggiamento ondulato |
Epidemiologia nei nostri mari
Numerosi Autori hanno mappato la presenza di questo parassita nei nostri mari, valutandone sia la prevalenza, ovvero la percentuale definita dal numero di individui della specie ospite infestata / numero di ospiti esaminati (essa è quindi una misura che quantifica la presenza di una parassitosi in una popolazione in un determinato momento), che l'intensità media, ovvero il numero totale di individui di una specie parassita in un campione di ospiti / numero di individui parassitati da quella specie ospite (essa fornisce una indicazione del numero medio di parassiti di una determinata specie in ogni ospite infetto).
Tali studi, dei quali si riportano alcune tabelle a titolo esemplificativo, ci permettono di prendere atto dell'entità del fenomeno e del suo interessamento ad ampio raggio su diverse specie ittiche.
Si rende noto che sono sempre in corso approfondimenti di indagine e monitoraggi mirati al fine di stimare continuamente l'entità del fenomeno ed il rischio collegato.
|
Tabella 4 - Parassiti rilevati nel Mar Ligure
|
| Ospite |
Prevalenza % |
Intensità media |
| Trachurus trachurus(Suro o Sugarello) |
90,62 |
20,5 |
| Trachurus picturatus (Suro o Sugarello) |
100 |
17,04 |
| Micromesistius poutassou (Melù o Potassolo) |
50 |
1,43 |
| * [Sono stati esaminati 882 individui di 5 specie diverse: Trachurus trachurus, Trachurus picturatus, Micromesistius poutassou, Mullus barbatus e Mullus surmuletus ] |
|
Tabella 5 - Parassiti rilevati nel Golfo di Napoli
|
| Ospite |
Prevalenza % |
| Engraulis encrasicolus (Acciughe) |
7.14% prevalenza in Acciughe < 9.5 cm |
42.85% prevalenza in Acciughe > 9.5 cm |
| * [3456 soggetti esaminati] |
|
Tabella 6 - Parassiti rilevati nel medio Adriatico
|
| Ospite |
n. campioni esaminati |
Valori positività in % |
| Scomber scombrus (sgombro) |
199
|
13,1 |
| Trachurus trachurus, (suro) |
98 |
40,8 |
| Sardina pilchardus (sardina) |
95 |
56,9 |
| Engraulis encrasicolus (acciuga) |
414 |
53,1 |
| * [ 906 pesci prelevati dai mercati ittici di Fano e di Ancona Ben 397 (43,8%) dei 906 pesci esaminati presentavano larve di nematodi Anisakidae dei generi Anisakis e Hysterothylacium ed in particolare 78 (8,6%) soggetti sono risultati positivi per la presenza di larve di Anisakis, 348 (38,4%) per Hysterothylacium, 3,2% coinfestazione sostenuta da entrambi i generi parassitari ] |
|
Tabella 7 - Prevalenza delle larve di nematodi della famiglia Anisakidae nei pesci del Mediterraneo
|
| Specia |
Nome comune |
Prevalenza |
| Lepidopus caudatus |
pesce sciabola |
100 |
| Trachurus trachurus |
suro |
95 |
| Micromesistius poutassou |
melù |
95 |
| Merlangius merlangius |
molo |
76 |
| Scomber japonicus |
lanzardo |
75 |
| Scomber scombus |
sgombro |
71 |
| Conger conger |
gronco |
44 |
| Merluccius merluccius |
nasello |
40 |
| Boops boops |
boga |
35 |
| Zeus faber |
pesce S. Pietro |
33 |
| Lophius piscatorius |
rana pescatrice |
32 |
| Todarodes sagittatus |
totano |
22 |
| Trachinus dracho |
tracina |
21 |
| Phycis phycis |
musdea |
20 |
| Trisopterus minutus |
busbana |
19 |
| Engraulis encrasicolus |
alice |
17 |
| Diplodus annularis |
sparaglione |
16 |
| Trigla lyra |
gallinella |
16 |
| Pagellus erytrinus |
pagello |
10 |
| Mullus barbatus |
triglia |
10 |
| Mugil cefalus |
cefalo |
9 |
| Cepola rubescens |
cepola |
9 |
| Sardina pilchardus |
sardina |
1 |
| * [Rapporti ISTISAN 05/24 - Zoonosi parassitarie trasmesse da prodotti ittici] |
Gravita' del pericolo Anisakis
Come noto, per "gravità" si intende l'importanza delle conseguenze che possono verificarsi qualora il pericolo si manifesti; consumando prodotto ittico crudo o poco cotto l'uomo, ospite accidentale, può contrarre una patologia di difficile diagnosi, con sintomi aspecifici e mutevoli che compaiono in genere dopo qualche giorno dal consumo del pesce incriminato.
Nello specifico, dopo l'ingestione delle larve queste possono localizzarsi nello stomaco o nel primo tratto dell'intestino tenue, inducendo mediante perforazione della mucosa una sintomatologia caratterizzata prevalentemente da flogosi granulomatose e/o flemmonose, con la formazione di un granuloma c.d. "eosinofilico".
Si descrive inoltre una forma intestinale caratterizzata da infiltrazione edematosa che provoca un ispessimento della mucosa e la formazione dei c.d. "flemmoni eosinofilici"; codesta forma clinica è maggiormente ascritta ad un altro Anisakidae, lo Pseudoterranova.
In bibliografia vengono descritte localizzazioni anche in esofago, mesentere, parete addominale, sul grande omento, pancreas, fegato, lingua e polmone, c.d. "sindrome da larva migrante".
Sono state inoltre segnalate reazioni allergiche in soggetti predisposti in seguito ad inalazione di particelle di pesce o manipolazione del prodotto intero o di farine, testimoniate da un incremento delle IgE totali e di quelle specifiche per Anisakis sp. con reazioni di orticaria, edema, anafilassi, asma.
Le segnalazioni bibliograficamente accertate di anisakidosi nell'uomo sono attualmente le seguenti: Bari, (Testini et al. 2003), Torino, (Caramello et al. 2003), Siena, (Montalto et al. 2005), Roma (Moschella et al. 2005), Bologna (Pezzilli et al. 2007), Bari, (Ugenti et al. 2007), Siena, (Marzocca et al. 2009), Terni, (Sola et al. 2011).
Buone pratiche igieniche in ambito domestico
Al fine di diminuire sensibilmente il rischio di zoonosi è opportuno applicare le direttive espresse dal Legislatore nonché, in ambito familiare, adottare alcune semplici precauzioni:
- eviscerare prontamente il pesce acquistato se non eviscerato all'origine,
- controllare che non vi siano parassiti visibili ad occhio nudo come riportato nelle immagini precedenti,
- congelare a - 20 ° C per almeno 24 ore il pesce, oppure - 35°C per almeno 15 ore.
Il trattamento termico ad almeno 60° C (temperatura da raggiungere a cuore del prodotto) per un tempo minimo di 10 minuti, devitalizza completamente il parassita escludendo così l'eventuale rischio per la salute umana in seguito ad un'accidentale ingestione.
Circa la resistenza delle larve, sono insufficienti trattamenti con olio e limone, olio e aceto, salagione ed affumicamento con temperature inferiori a 30 ° C.
In particolare Arcangeli et al (1996) hanno dimostrato come a seguito del trattamento con NaCl a concentrazione superiore o uguale al 10% abbinato ad un periodo di conservazione in olio a 4°C, si ottenga una progressiva devitalizzazione delle larve fino ad una totale devitalizzazione dopo 13 giorni.
Inoltre Sanchez-Monsalvez et al. (2005) hanno rilevato che utilizzando un parametro fisso di NaCl 12 %, la devitalizzazione del parassita avviene in tempi variabili in base le seguenti combinazioni:
- + 10 % acido acetico , morte dopo 5 gg di marinatura,
- + 40 % acido acetico , morte dopo 2 gg,
- + 6% acido acetico , morte dopo 13 gg.
Conclusioni
Alla luce di quanto sopra esposto si evidenzia che il maggior consumo di pesce crudo impone un'attenta valutazione del rischio ai fini di una efficace profilassi.
Il consumatore dovrà essere consapevole dell'eventuale pericolo cui può incorrere consumando pesce crudo, ma altrettanto consapevole che il rispetto delle buone pratiche igieniche congiuntamente ad un attento esame visivo del prodotto riducono esponenzialmente il rischio di anisakiasi.
Bibliografia
Ana I., Mahillo R., Gonzales-Munoz M, Moneo I., Solas M.T., Mendizabal A., De las Heras C., Tejada M. (2008). Allergenic Properties and Cuticle Microstructure of Anisakis simplex L3 after Freezing and Pepsin Digestion, Journal of Food Protection, n. 71 (5), pag 2578-2581.
Arcangeli G.; Galuppi A.; Bicchieri M.; Gamberini R.; Presicce M. (1996). Prove sperimentali sulla vitalità di larve del genere Anisakis. Industria Conserve, n. 4 (71), pag 502-507.
Caramello P., Vitali A., Canta F., Caldana A., Santi F., Caputo A., Lipani F., Balbiano R. (2003). Intestinal localization of anisakiasis manifested as acute abdomen. Clinical Microbiology and Infection, n. 7 (9), pag. 734-737.
Marzocca G., Rocchi B., Lo Gatto M., Polito S., Varrone F., Caputo E., Sorbellini F. (2009). Annali Italiani di chirurgia. 2009, n. 1 (80), pag 65-68.
Montalto M., Miele L., Marcheggiano A., Santoro L., Curigliano V., Vastola M., Gasbarrini G. (2005). Anisakis infestation: a case of acute abdomen mimicking Crohn's disease and eosinophilic gastroenteritis. Digestive and Liver Disease. n. 1 (37), pag. 62-64.
Moschella C. M.; Mattiucci S.; Mingazzini P.; Mongardini M.; Chein A.; Miccolis D.; Modini C. (2005). Intestinal Anisakiasis in Italy : a case treated by emergency surgery. Il Giornale di chirurgia, n. 5 (26), pag. 201-205.
Panebianco A., Lo Schiavo A., (1985). Indagine sulla presenza di larve Anisakidi in aringhe salate e affumicate del commercio. Considerazioni d'ordine ispettivo. La Clinica Veterinaria, pag 285, vol 2.
Panebianco, A.; Giuffrida, A.; Minniti, A.; Ziino, G.; Calabrò, P.; Triglia, F. (2000). Effect of some gases on the excystation of Anisakis larvae in Lepidopus caudatus. Industrie Alimentari, n. 39 (39), pag 467-470.
Pezzilli R., Casadei R., Santini D. (2007). Autoimmune pancreatitis associated with Anisakis infection. Digestive and Liver Disease, n. 3 (39), pag. 273.
Pozio E. (2005). Zoonosi parassitarie trasmesse da prodotti ittici. Rapporti ISTISAN 05/24 in Atti del Workshop di aggiornamento su problematiche emergenti nel settore dei prodotti ittici Istituto Superiore di Sanità Roma, 24-25 Maggio 2004.
Sanchez-Monsalvez I., De Armas-Serra C., Martinez J., Dorado M., Sanchez A., Rodriguez-Caabeiro F. (2005). A new procedure for marinating fresh anchovies and ensuring the rapid destruction of Anisakis larvae. Journal of Food Protection, n. 68 (5), pag 1066-1072.
Sola D., (2011). Anisakis: l'evoluzione della normativa - Anisakis: the evolution of regulations. Sanità Pubblica Veterinaria, n. 69, Dicembre, http://indice.spvet.it#537.
Tejada M., Solas M. T., Navas A., Mendizabal A. (2006). Scanning Electron Microscopy of Anisakis Larvae following Different Treatments. Journal of Food Protection, n. 69(6), pag 1379-1378.
Testini M., Gentile A.,. Lissidini G, Di Venere B.,. Pampiglione S. (2003). Splenic anisakiasis resulting from gastric perforation: An unusual occurrence. International Surgery, n. 88 (3), pag. 126-128.
Ugenti I., Lattarulo S., Ferrarese F., De Ceglie A., Manta R., Brandonsio O. (2007). Acute gastric anisakiasis: An italian experience. Minerva Chirurgica, n. 62, pag. 51-60.
Riferimenti normativi
Circolare Ministero della Salute 11/03/1992.
Circolare n.1/97 della Regione Liguria.
Decreto Legislativo n. 193/2007.
Legge 30 aprile 1962 n. 283.
Legge 30 aprile 1962, n. 283 Modifica degli artt. 242, 243, 247, 250 e 262 del T.U. delle leggi sanitarie approvato con R.D. 27 luglio 1934, n. 1265 (Disciplina igienica della produzione e della vendita delle sostanze alimentari e delle bevande).
Ordinanza Ministero della Salute 12 maggio 1992, Misure urgenti per la prevenzione delle parassitosi da Anisakis.
Regolamento (CE) n. 852/2004 del Parlamento Europeo e del Consiglio del 29 aprile 2004 (Igiene dei prodotti alimentari).
Regolamento (CE) N. 853/2004 del Parlamento Europeo e del Consiglio del 29 aprile 2004 (norme specifiche in materia di igiene per gli alimenti di origine animale).
Sentenza N.9276 UD. 19 Gennaio 2011 - Deposito del 9 Marzo 2011. Alimenti e Bevande - Legislazione Speciale - Entrata in vigore dei decreti attuativi in tema di semplificazione legislativa - Abrogazione - Esclusione.








