Webzine Sanità Pubblica Veterinaria®
Numero 18 - febbraio 2003
http://www.pg.izs.it/webzine.html
torna indietro
Micotossine negli alimenti e micotossicosi animale e umana
M. Naceur Haouet e M. Serena Altissimi
L'istituto Zooprofilattico Sperimentale dell'Umbria e delle Marche si occupa da anni della determinazione delle micotossine, sia a livello pubblico sanitario che sul fronte privato, come sostegno agli allevamenti, acquisendo in tal campo una esperienza non indifferente.
Ultimamente, negli allevamenti si osserva una sostanziale recrudescenza di problemi sanitari riconducibili ad effetti tossicologici, probabilmente legati alla presenza di micotossine.
Di fronte alla richiesta sempre maggior di tale analisi, all'aumento di positività rispetto agli anni 1992-1996 con livelli anche sostanziali (vedi grafici di seguito riportati) e alla ricerca continua da parte dell'utenza di informazioni sull'azione di tali sostanze e sulla loro dose tossicologica, abbiamo ritenuto utile portare un contributo presentando questo lavoro.
Il presente studio non vuole tuttavia essere esauriente sull'argomento e riporta un'elaborazione parziale dei dati da noi ottenuti, essendo essa riferibile agli anni 1992-1998, sulla presenza delle micotossine di maggior interesse. Pensiamo comunque che esso possa sicuramente essere di interesse e ci proponiamo di presentare prossimamente i risultati aggiornati agli ultimi 4-5 anni.
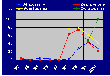
[% di positività di Aflatossine, Zearalenone,
Vomitossina e Ocratossina negli alimenti ad uso zootecnico dal 1992 al 2000 (dati IZSUM)]
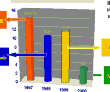
[contenuti medi di aflatossine (dati IZSUM)]

[zearalenone e vomitossina tra il 1997 e il 2000 (dati IZSUM)]
PRIMA PARTE: STUDIO DELLA LETTERATURA
Il termine micotossine comprende numerosi metaboliti secondari con attività tossica prodotti in opportune condizioni microclimatiche da funghi microscopici e filamentosi, meglio noti come "muffe"; solo un ridotto sotto insieme di questi microrganismi produttori può attivare le vie metaboliche secondarie che conducono alla sintesi di micotossine.
Le derrate alimentari, le granaglie ed i mangimi per, gli animali rappresentano i substrati ideali per l'accrescimento dei funghi produttori della veicolazione delle micotossine (Smith, 1991).
Le micotossine, oltre ad essere molto diverse tra loro dal punto di vista chimico, mostrano una notevole gamma di effetti biologici dovuti alla loro capacità di interagire con diversi organi e/o sistemi bersaglio (Hsieh, 1987). Per tale ragione, esse sono classificate in immunotossine, dermatossine, epatotossine, nefrotossine e neurotossine oppure sulla base del loro effetto cronico in mutagene, cancerogene e teratogene (Krogh, 1974).
Tutte queste attività biologiche sono dovute ad interazioni delle micotossine e/o ai loro derivati con DNA, RNA, proteine funzionali, cofattori enzimatici, costituenti di membrana.
Gli effetti tossici osservati raramente possono dare origine a fenomeni patologici di tipo acuto ed il rischio maggiore risiede nel loro accumulo che può originare sintomatologie di tipo cronico (Berry, 1988).
Gli effetti tossici osservati consentono di classificare le patologie in micotossicosi acute primarie, croniche primarie e croniche secondarie.
Il primo gruppo comprende patologie, talvolta mortali, dovute all'introduzione di micotossine in quantità molto elevate in un periodo di tempo molto limitato.
Al contrario le micotossicosi croniche primarie sono fenomeni meno pericolosi sul breve termine, difficilmente diagnosticabili e di conseguenza comportano notevoli danni economici.
Le micotossine causano seri danni alla salute umana e possono provocare notevoli danni economici negli allevamenti e negli impianti zootecnici dovuti ad un calo nella fasi produttive e riproduttive (Grasso, 1983).
Le micotossine, pur risalendo a tempi remoti, sono state scientificamente oggetto di studio, specie nel campo veterinario, solo a partire del 1850 quando si è dimostrata l'associazione tra l'ingestione di segale contaminata con sclerozi di Claviceps purpurea e la comparsa di casi di ergotismo.
Uno degli esempi meglio documentati di micotossicosi umana risale agli anni '40, nel distretto di Oremberg in Russia, dove fu descritta l'insorgenza di una tossicosi alimentare correlata all'ingestione di cereali colonizzati da Fusarium sporotrichioides e da F. poae. L'inizio della moderna micotossicologia è databile al 1960, anno in cui vennero identificati le aflatossine, prodotte da Aspergillus flavus e Aspergillus parasiticus, e la loro presenza correlata alla "malattia X" del tacchino.
Le micotossine sono metaboliti secondari, tossici per gli animali superiori, prodotti da muffe che colonizzano gli alimenti.
Il termine metabolita secondario significa che non si è in grado di attribuire loro alcun ruolo evidente nella crescita dell'organismo che le produce.
Le micotossine non costituiscono una classe chimica ma hanno tra loro strutture molto diverse. Il metabolismo primario è fondamentalmente lo stesso per tutti gli esseri viventi; quello secondario dipende invece dalla specie e talvolta dal ceppo fungino.
Da ciò la gran diversità di molecole prodotte, anche se per famiglie di prodotti simili.
Attualmente, sono note più di 300 micotossine e sono stati elencati numerosi generi di funghi produttori di micotossine, anche se la maggior parte delle ricerche sono concentrate su aflatossine, ocratossine, tricoteceni, zearalenone e fumonisina.
Solo il 7% delle oltre 300 micotossine identificate si ritrovano negli alimenti a livelli significativamente elevati tali da costituire un pericolo per la salute umana.
I funghi produttori di tossine appartengono principalmente a tre generi molto diffusi: Aspergillus, Penicillium e Fusarium (vedi figura seguente).
Tra le micotossine meglio conosciute e studiate che creano maggiori preoccupazioni per la salute umana si riportano le famiglie delle aflatossine (prodotte soprattutto dall'Aspergillus), delle ocratossine e patulina (prodotte dal Penicillium), degli zearalenoni, fumonisine e tricoteceni (prodotti dal Fusarium).
La formazione delle micotossine è strettamente connessa alla crescita fungina; senza di essa, la produzione di tossine non avviene. Inoltre, la presenza di funghi tossigeni in un alimento non indica automaticamente la presenza di micotossine, specialmente se non vi è crescita fungina.
D'altra parte, le tossine possono persistere per lungo tempo dopo la crescita vegetativa e la morte e/o l'eliminazione del fungo. L'assenza di ceppi fungini negli alimenti non indica pertanto necessariamente l'assenza anche di micotossine.

[micotossine e salute umana]
All'interno di una specie fungina, esistono ceppi che producono molte tossine, sia come quantità sia come varietà, e altri che ne sintetizzano poche o nessuna, senza differenze significative né nello sviluppo né nei caratteri morfologici. Ne consegue che l'analisi micologica, basata sulla numerazione delle unità vitali e l'identificazione delle specie fungine, non permette di quantificare il rischio tossico proprio di un prodotto alimentare, rischio che può essere quantificato solo attraverso l'analisi delle micotossine note o con test di tossicità.
I trattamenti tecnologici, se effettuati correttamente, sono tuttavia spesso in grado di inattivare gran parte delle micotossine presenti nell'alimento, come si può osservare nelle figure seguenti.

[degradazione dell'aflatossina b1 da trattamenti termici]

[Degradazione dell'ocratossina A e della vomitossina da trattamenti termici]
Esistono diversi metodi di detossificazione. Ne riportiamo alcuni:
- detossificazione fisica:
- calore secco e umido (cottura in forno, autoclave, arrostimento, torrefazione, friggitura);
- irragiamento solare e con microonde.
- detossificazione chimica:
- acqua ossigenata (succhi di frutta, brodi proteici, latte);;
- ammoniaca (semi e panelli di arachidi, di cotone e di mais);
- idrossido di calcio;
- aldeide formica;
- etere metilico.
Lo sviluppo di muffe tossigene e la successiva sintesi di micotossine può avvenire in qualsiasi delle fasi del ciclo produttivo dell'alimento, a partire dalla coltivazione fino ad arrivare al consumo.
La figura seguente illustra il diagramma di flusso con le fasi più importanti nella produzione di micotossine e il conseguente rischio di micotossicosi sia animale che umano.
Le micotossine possono giungere al nostro tavolo sia direttamente attraverso le derrate vegetali contaminate (frutta tropicale, frutta secca, frutta a guscio, cereali, spezie, pianti infusionali, ecc.) che mediante ingestione da parte del bestiame e successiva metabolizzazione e stoccaggio nei tessuti, qualora non sussistono casi acuti di micotossicosi animale.
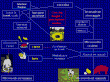
[crescita funghi e produzione tossine]
Formazione di micotossine durante la coltivazione
Una delle fasi principali durante la produzione di un alimento a cui non si presta in genere sufficiente attenzione è quella della coltivazione. Questa risulta di estrema importanza per la presenza delle micotossine sintetizzate dai funghi della specie Fusarium.
Frumento e mais sono i più colpiti. Il fungo persiste a lungo nel suolo, nei residui di tessuti vegetali, dopo la mietitura, sotto forma di ascospore e macroconidie che rappresentano le sue forme di sopravvivenza.
L'infezione della pianta è favorita dall'antesi (apertura del fiore) ed è necessaria una superficie umida per 48-60 ore, a temperatura non inferiore a 15°C. Il mais è il più soggetto ad ammuffimento dopo una pioggia di 6-90 giorni.
Oltre ai fattori climatici, l'attacco da parte degli insetti è particolarmente predisponente all'infezione.
E' interessante considerare che essi causano una differenziazione tra le sepcie funginee, nel senso che un determinato insetto favorisce una specie piuttosto che un'altra.
I ceppi di Fusarium tossigeni rappresentano un problema di ordine mondiale e sono stati isolati in Norvegia, Argentina, Austria, Bulgaria, Canada, Cina, Francia, Germania, Grecia, Ungaria, Italia, Giappone, Corea, Nepal, Polonia, Portogallo, Russia, Svezia, UK, Yemen, Spagna, Olanda, Brasile, Finlandia, Egitto, Nigeria, India, Sud Africa, Australia e Nuova Zelanda.
Inoltre, colpiscono molte piante tra cui frumento, mais, orzo, avena, riso, sorgo, segale, patate, banane, semi di mostarda, semi di soia, mango, arachidi, semi di girasole, cassava e anche gli steli alti dell'erba.
Il marciume della patata rappresenta un grosso problema in America e nell'Europa con elevate concentrazioni di micotossine.
Le banane sono spesso molto contaminate; è stato osservato che quelle che provengono dall'India presentano livelli che superano i 90 mg/Kg. Nel 1994, il 100% delle banane provenienti da Ecuador, Panama e Canarie sono infette da ceppi tossigeni.
Normalmente le piante sono resistenti all'infezione fungina ma in condizioni di stress (carenze minerali, aumento della salinità del suolo, attacco da insetti, stress idrico) diventano suscettibili.
Per quanto le aflatossine, Aspergillus flavus e A. parassiticum possono virtualmente sintetizzarle su qualsiasi pianta infettata, ma il pericolo esiste soprattutto nelle regioni a clima tropicale e simili. Elevati livelli di contaminazioni sono state osservate su mais, arachidi, noci, pistacchi, cotone, copra, mandorle, uva, spezie, fichi, mentre soia, fagiolo, leguminose, cassava, sorgo, frumento, orzo, avena e riso sono normalmente resistenti.
L'ocratossina A è stata rilevata in mais, frumento, sorgo, avena, riso e caffè. L'orzo e l'avena che crescono nei paesi scandinavi ed in particolare in Danimarca presentano spesso elevati livelli di contaminazione.
Il più alto contenuto di micotossine nei cereali sembra dovuto alle piogge, in particolare durante l'ultima fase di accrescimento e prima della raccolta. In Svezia, sono stati osservati contenuti di vomitossina di 40-260 ppb nel 1982 (annata di siccità) e di 50-1160 ppb, nel 1984 (annata particolarmente piovosa).
Se da un lato le piante possono, grazie a diversi sistemi enzimatici, modificare il contenuto di micotossine, dall'altro sembrano traslocare tale sostanze dal sito di produzione al baccello e al fusto, e quindi alle foglie. Le micotossine si ritrovano pertanto nei foraggi.
Formazione di micotossine durante lo stoccaggio
I fattori che maggiormente influenzano la colonizzazione delle piante da funghi e la produzione di micotossine sono l'acqua libera, la temperatura e il tempo di permanenza, durante lo stoccaggio.
Mentre la sintesi delle micotossine da Fusarium (zearalenone, vomitossina, …) avvengono principalmente durante la fase di coltivazione, quelle da Aspergillus e Penicillium (aflatossina, ocratossina) si verificano soprattutto durante lo stoccaggio degli alimenti.
Al contrario di quanto si verifica durante la coltivazione (formazione di aflatossine in paesi tropicali e sub-tropicali), la sintesi delle aflatossine durante lo stoccaggio può avvenire anche nelle zone temperate e più fredde.
Fattori influenzanti lo sviluppo di funghi e la sintesi di micotossine
Con il termine di specie fungina tossina, si intende collettivamente un numero indefinito di ceppi capaci di elaborare, in determinate condizioni, uno o più metaboliti tossici. In effetti, per la maggior parte delle specie considerate tossinogene, non tutti i ceppi possiedono questa potenzialità.
La proporzione di ceppi tossinogeni dipende dalla specie fungina e, per una stessa specie, dalla zona geografica e climatica di provenienza, dal substrato di origine e dalle condizioni generali di sviluppo. Inoltre, il potenziale tossigeno può essere estremamente variabile a seconda dei ceppi.
In una ricerca condotta su 37 ceppi di Aspergillus versicolor, insemenzati su mais umidificato, a 27°C per 13 giorni, la concentrazione della micotossina prodotta (sterigmatocistina) variava da 0,4 a 1400 ppm. Questa variabilità non aveva origine in una differente attività metabolica generale, dato che la gran maggioranza di tali ceppi non mostrava sensibili differenze nella velocità di crescita.
La diversità nella concentrazione della micotossina rifletteva invece la grande disuguaglianza che esiste nel potenziale tossigeno tra i diversi ceppi di una stessa specie.
Le muffe capaci di produrre micotossine sono contaminanti assai diffusi degli alimenti e dei prodotti zootecnici; crescita e produzione di tossine possono avvenire sia in campo sia in magazzino. I principali fattori, illustrati nella figura seguente, che consentono la tossinogenesi sono:
- fattori intrinseci, legati al ceppo fungino;
- il potenziale tossigeno che può variare tra i ceppi da 1 a 103-104;
- la specie fungina che determina le classi di micotossine prodotte;
- il livello iniziale di contaminazione che influenza la quantità di tossine sintetizzabili (più muffe, maggior quantità potenziale di micotossine);
- fattori estrinseci, costituiti dall'insieme delle condizioni ecologiche; questi fattori sono prima di tutto determinanti per lo sviluppo fungino, e di conseguenza per la produzione di micotossine;
- fattori chimici, fisico-chimici e fisici quali l'umidità, l'acqua libera (aw), la temperatura, la natura del substrato, la composizione gassosa (atmosfera) e i danni meccanici alla cariosside;
- fattori biologici, quali gli insetti, sia come vettori di spore fungine che come agenti di lesioni alle cariossidi, favorendo l'insediamento delle muffe; la microflora, con risultante competizione tra le specie fungine; lo stress della pianta (siccità); la resistenza del substrato, intesa sia come resistenza genetica sia come integrità delle cariossidi.
Per prevenire la contaminazione delle derrate alimentari da micotossine, occorre impedire la crescita fungina.
Per ciò, bisogna prendere un insieme di misure che scaturiscono dalle leggi che regolano la vita delle muffe: essi hanno bisogno di acqua, di ossigeno (almeno 1-2%), di tempo e di temperatura adeguata (variabile in funzione delle specie; in genere, quelle alte favoriscono gli Aspergilli, quelle basse i Fusarium).
Una delle caratteristiche comuni delle specie fungine nelle derrate poco idratate è la loro grande capacità di sporulazione e di disseminazione.
Le condizioni ideali di sviluppo si possono riassumere nei punti seguenti:

[fattori influenzanti lo sviluppo di funghi o la sintesi di micotossine]
Umidità ambientale o acqua libera (aw)
Il parametro cui prestare maggior attenzione è l'aw. La colonizzazione fungina degli alimenti si verifica più frequentemente di quella batterica a livelli di aw inferiore 0,85; questo non perché i funghi non possano crescere a tenori più elevati, ma piuttosto perché i batteri sono fortemente competitivi e diventano la microflora predominante a valori di aw compresa tra 0,85 e 1,00, in particolare con livelli superiori a 0,90-0,93.
Con un'aw compresa tra 0,85 e 0,93, solo alcuni batteri possono moltiplicarsi rapidamente, in particolare germi lattici e cocchi, per cui l'invasione da parte di muffe e lieviti prende il sopravvento.
In base alle loro differenze di comportamento in funzione delle disponibilità di acqua, le specie fungine sono state classificate in:
- igrofile (ad esempio, Epicoccum nigrum, Trichothecium roseum, Mucor circinelloides):le spore germinano solo a valori di aw superiori a 0,90 e la crescita ottimale si colloca a 1,00;;
- mesofile (ad esempio, Alternaria tenuissima, Cladosporium cladosporioides, Penicillium cyclopium): le spore germinano a valori compresi tra 0,80 e 0,90 di aw; l'ottimo di crescita si osserva tra 0,95 e 1,00;
- xerofile (ad esempio, Aspergillus repens, Aspergillus restrictus, Aspergillus versicolor): le spore germinano ad un valore di aw inferiore a 0,80 e la crescita ottimale si osserva intorno a 0,95.
Il valore di aw minimo al quale è stata osservata una crescita fungina è di 0,61. Tuttavia, non si conoscono specie tossigene in grado di crescere con valori di aw < 0,78. Inoltre, i livelli minimi richiesti per la sintesi delle micotossine sono generalmente superiori a quelli necessari per la crescita fungina.
A valori di aw bassi (0,25-0,30), l'acqua è fissata al substrato con legami energici forti, ma mano a mano che questi livelli aumentano, cresce il suo grado di disponibilità (o di libertà) ed i suoi legami con il substrato diventano più deboli.
Non va dimenticato che la disponibilità di acqua dipende anche da fattori ambientali; così, l'aw limite per la tossinogenesi è tanto più bassa quanto più la temperatura si avvicina a quella ottimale per una determinata specie fungina.
La relazione tra aw e umidità non è lineare e ogni tipo di derrata ha una sua propria curva di assorbimento, o curva di equilibrio acqua-substrato, detta isoterma di assorbimento dell'acqua; questo fattore spiega come il tenore in acqua corrispondente al valore di aw da non superare (0,65 circa) per assicurare una buona conservazione, sia diversa in funzione dell'alimento.
Ad esempio, a temperature di 25°C, l'umidità non deve superare il 13-13,5%, per i cereali, e il 7-8% per i semi oleosi.
Temperatura
Le temperature ideali per lo sviluppo di una muffa sono comprese tra 15 e 30°C, con un optimum di 20-25°C.
Tuttavia alcune specie, quale Cladosporium herbarium, presentano una crescita apparente a -6°C, ed altre, quali alcune specie di Penicillium, possono manifestarsi su pesce congelato a -20°C. Si ricorda a titolo di curiosità che alcune spore (Rhizopus nigricans, Mucor mucedo, Aspergillus niger, Aspergillus glaucus) non hanno subito nessun trauma dopo essere state per 77 ore nell'idrogeno liquido a -253°C e per 492 ore in aria liquida a -190°C.
Alle alte temperature, il micelio generalmente non si manifesta, se si escludono alcune specie patogene, quale l'Aspergillus fumigatus che alle temperature corporee infestano visibilmente le prime vie respiratorie e che tollera temperature pari o superiori ai 50°C.
Ben oltre i 35-40°C sopravvivono invece le forme di riproduzione di molte specie, quale il Monilia sitophila, tipico contaminante ambientale dei panifici, che causa l'ammuffimento arancione del pane, o l'Aspergilles flavus, abitante indesiderato dei tunnel di essiccamento delle paste alimentari in cui produce un flora molto abbondante.
Altre muffe, ancora, possono crescere a temperature sia basse che elevate; è il caso del Botrytis cinerea, ospite indesiderato delle colture in serra e agente di ammuffimento di frutta stoccata in celle frigorifere; questa si sviluppa benissimo a 20°C ma la sua crescita resta veloce anche a 5°C.
pH e ossigeno
Lo sviluppo del micelio avviene a valori di pH compresi tra 4 e 8; tuttavia, alcune muffe possono manifestarsi anche a valori più bassi o più elevati, modificando opportunamente l'acidità del mezzo, mano a mano che il micelio si sviluppa.
Le muffe sono generalmente organismi aerobi che si sviluppano sulla superficie dei substrati. Diverse specie tuttavia possono crescere anche in profondità, come lo Stachybotrys, o in mezzi liquidi, con basso tenore di ossigeno, assumendo un aspetto levuliforme o gelatinoso, o ancora in atmosfera modificata con CO2 e N2.
Ad esempio, in caso di marcata contaminazione degli ambienti di produzione di paste fresche farcite (tortellini, ravioli, cappelletti), Byssochlamys nivea e Paecilomyces niveus sono in grado di manifestarsi sui prodotti, in confezioni ancora integre, sotto forma di ammuffimento bianco diffuso o puntiforme, qualora la temperatura di conservazione non venga mantenuta rigorosamente a livelli di refrigerazione.
Tossinogenesi
Se sussistono le condizioni ambientali sopra descritte, lo sviluppo delle muffe negli alimenti è poco influenzato dalla natura del substrato.
Non è invece il caso della produzione delle loro micotossine, dove il tipo di substrato e le condizioni ambientali assumono dei limiti molto più delineati.
Infatti, la tossinogenesi è favorita da livelli di aw dei substrati superiori a quelli richiesti per lo sviluppo fungino, e comunque sempre vicino a 0,90. L'Aspergillus flavus può iniziare la produzione di aflatossine già a 0,83, mentre A. ochraceus necessita almeno di 0,97 per produrre ocratossine.
L'umidità del substrato, espresso come aw è pertanto il vincolo principale per prevenire la tossinogenesi in un alimento, per cui il suo controllo è diventato indispensabile, per esempio in mangimistica.
Relativamente alle condizioni termiche, A. flavus produce aflatossine preferibilmente intorno ai 25°C e non è mai stata evidenziata una tossinogenesi a temperature inferiori a 10°C. A queste ultime temperature, sono state prodotte aflatossine, in latte in polvere umidificato, e intorno a 12°C, in formaggi contaminati da A. parasiticus.
Il Fusarium graminearum produce zearalenone intorno a 14°C e anche a temperature inferiori, come il Fusarium tricinctum che è in grado di produrre la tossina T2 a temperature comprese tra 1 e 4°C e fino a 15°C.
Aspergillus ochraceus produce ocratossina in un intervallo di temperatura compreso tra 20 e 30 °C, e comunque mai al di sotto di 12°C.
La stessa micotossina viene prodotta da Penicillium viridicatum tra 4 e 31°C.
E' pertanto difficile generalizzare dei limiti di contenimento, se si esclude la produzione di aflatossine che non sono mai state isolate al di sotto di 10°C, neanche in substrati fortemente ammuffiti.
Il tenore di ossigeno e l'acidità del substrato rappresentano fattori irrilevanti per il potenziale tossinogenico delle muffe.
Il tipo di substrato è invece l'elemento che probabilmente più di ogni altro influenza la tossinogenesi.
E' ormai noto che i vegetali favoriscono la produzione di micotossine, più dei substrati animali; la presenza soprattutto di amido sembra incrementare la micotossinogenesi e, in particolare, la presenza di zinco limitatamente alla sintesi di aflatossine.
I cereali, i semi oleaginosi e la frutta secca sono al vertice degli alimenti più frequentemente contaminati da aflatossine, tra i quali mais, arachidi e semi di cotone rappresentano i prodotti più a rischio.
La frutta e i loro succhi sono invece i principali veicoli di patulina, mentre i cereali quelli di ocratossina.
Tra gli alimenti di origine animale, il latte è uno dei prodotti in cui la migrazione di aflatossine è più evidente, qualora le vacche siano alimentate con prodotti zootecnici molto contaminati.
Le aflatossine, infatti, sono dei derivati della cumarina (struttura fumaro-cumarinica), con punto di fusione a 250°C, che subiscono, dopo ingestione, una trasformazione a livello del fegato in metaboliti polari che sono generalmente meno tossici e possono essere eliminati attraverso l'urina; tuttavia, durante la detossificazione può avvenire la formazione di un prodotto secondario, molto reattivo, derivante dall'epossidazione in posizione 8-9 delle molecole originarie.
I metaboliti epossidati sono in grado di legarsi covalentemente, oltre che alle molecole di RNA e DNA, alle proteine cellulari.
In tal caso, nel latte, compaiono molecole idrossilate delle aflatossine B1 e B2, denominate M1 e M2, associate alle proteine. E' stato calcolato che, quando le vacche ingeriscono alimenti contaminati da aflatossina B1, la trasformazione nella forma M1 è, 24 ore dopo l'assunzione, in un rapporto compreso tra 0,6 e 0,3% (fattore di conversione compreso tra 170 e 300; occorrono cioè da 170 a 300 ppb di aflatossina B1 nell'alimentazione delle vacche per produrre 24 ore dopo 1 ppb di aflatossina M1 nel latte).
Essendo legate alle proteine, le aflatossine si possono anche nei prodotti lattiero-caseari. Va considerato che nei formaggi è possibile ritrovare, oltre alle aflatossine, altri prodotti tossici elaborati dalle muffe presenti sulla crosta.
Nel fegato, il fattore di conversione delle aflatossine è stato stimato a valori pari a 14000, per il bovino, 800 per il suino e 1200 per il pollo.
Per quanto riguarda i prodotti carnei, è ormai stabilito che applicando basse temperature nella produzione e nella conservazione, il rischio di micotossinogenesi è estremamente limitato; su prosciutti crudi stagionati è stata messa in evidenza la possibilità di produrre ocratossina da parte di Aspergillus ochraceus solo se la temperatura di conservazione raggiungeva i 25-30°C; in tal caso, dopo 21 giorni di mantenimento a questa temperatura, la micotossina era penetrata nella massa carnea fino a mezzo centimetro di profondità, in quantità pari a due terzi della produzione totale della muffa.
Anche per le carni fresche e conservate, è stato messo in evidenza, utilizzando esclusivamente le basse temperature, l'impossibilità per i ceppi fortemente tossinogeni, insemenzati sperimentalmente, di produrre metaboliti tossici, almeno in quantità degne di nota.
Anche la contaminazione delle uova da micotossine è rara; può eventualmente derivare dalla contaminazione dei mangimi utilizzati per l'alimentazione delle galline ovaiole.
Per la migrazione di aflatossine è stato calcolato un fattore di conversione pari a 2200 (occorrono cioè 2200 ppb di aflatossine nei mangimi per ritrovare 1 ppb nelle uova deposte).
| Fattore di conversione in prodotti di origine animale |
| Prodotto | Fattore di conversione | Aflatossine |
| Latte | 170 - 300 | M1, M2 |
| Uova | 2200 | B1, B2, G1, G2 |
| Fegato bovino | 14000 | B1, B2, G1, G2 |
| Fegato suino | 800 | B1, B2, G1, G2 |
| Fegato di pollo | 2200 | B1, B2, G1, G2 |
EFFETTI DELLE MICOTOSSINE SULLA SALUTE ANIMALE ED UMANA
Le micotossine possono provocare svariate patologie a danno di animali e persone. L'impatto economico dovuto alla perdita produttiva è incrementato dalla compromissione immunitaria (danno leggero cronico agli organi vitali ed ai tessuti), ed alla ridotta capacità produttiva.
Le Aflatossine possono provocare danni al fegato, diminuzione della produzione di latte e di uova e carenza immunitaria in animali che abbiano consumato anche basse quantità di alimento contaminato senza che vi siano manifestazioni cliniche evidenti.
Sebbene solitamente siano i giovani animali i più suscettibili, tutte le età possono essere colpite. I segni clinici tipici sono: disfunzioni gastroenteriche, riduzione della riproduzione, inappetenza, anemia ed ittero.
Gli animali da latte possono essere contaminati a loro volta da metaboliti di Aflatossine presenti nel latte.
Le micotossine Tricotecene rappresentano un vasto gruppo che causa necrosi ed emorragie in tutto il tratto digestivo, riduzione dei processi rigenerativi del sangue, del midollo e della milza ed inoltre mutazioni agli organi riproduttivi.
Le affezioni sono manifestate da calo del peso, scarsa assunzione del cibo, temporanea inappetenza, vomito, diarrea emorragica, aborto spontaneo, e morte.
La diminuzione delle difese immunitarie è un significativo sintomo di assunzione di micotossine tricotecene.
La teratogenicità è stata riscontrata in almeno una specie di mammifero per Aflatossina, Ocratossina e Zearalenone.
In alcune circostanze gli effetti neurologici sono complicati da diarrea, emorragie del tratto digestivo (da diverticolite), ipersalivazione, rifiuto del cibo e gangrena agli arti, alle orecchie e alla coda.
Almeno tre micotossine (Aflatossina, Ocratossina e Sterigmatocistina) sono conosciute come induttori di tumori in una o più specie animale.
Il cancro può svilupparsi nel fegato, reni, sistema urinario, tratto digestivo e polmone.
Gli unici effetti provocati da alcune micotossine sono: dermatite da contatto e in alcune specie causa la morte diretta dei tessuti nervosi nel cervello amplificando la sensibilità di alcuni organi.
Il comportamento di queste micotossine, la cui ampiezza e patogenicità è causa di patologie animali, rende questo gruppo di tossine naturali pericolose per la salute animale e un costante rischio per la contaminazione dei cibi.
L'Ocratossina-A danneggia i reni degli animali domestici e selvatici che abbiano consumato cibo contaminato da questa micotossina.
Alte concentrazioni di alimenti contenenti Ocratossina-A possono causare danni al fegato, necrosi ed emorragie intestinali.
Lo Zearalenone, a concentrazioni inferiori a un ppm, determina uno sconvolgimento delle attività ormonali legate alla riproduzione che portano a ipofertilità e iperestrismo (sindrome estrogenica).
Concentrazioni superiori, invece, possono causare problemi al concepimento dovute ad un mancato impianto degli ovuli e conseguente sviluppo fetale.
Altri effetti sono stati attribuiti alle micotossine quali: la morte embrionale, l'inibizione dello sviluppo ormonale, mentre aborti spontanei associati ad ergotismo sono messi in relazione a presenza di Aflatossine, rubratossine e Zearalenoni in animali gravidi.
La teratogenicità è stata riscontrata in almeno una specie di mammifero per Aflatossina, Ocratossina e Zearalenone.
Le funzioni del sistema nervoso sono alterate contrariamente da almeno nove micotossine.
I segni clinici sono: tremori, movimenti scoordinati, debolezza di uno o più arti, vertigini, e improvviso collasso muscolare provocato dalla consumazione di foraggi contaminati, insilati, cereali e integratori.
In alcune circostanze gli effetti neurologici sono complicati da diarrea, emorragie del tratto digestivo (da diverticolite), ipersalivazione, rifiuto del cibo e gangrena agli arti, alle orecchie e alla coda.
Per maggior semplicità e praticità ai lettori vengono di seguito trattate separatamente le micotossine considerate.
1) Aflatossina
Alcuni funghi appartenenti al genere Aspergillus, in particolare Aspergillus flavus ed Aspergillus parasiticus possono colonizzare sia le coltivazioni in campo che i prodotti, originariamente indenni, in una fase successiva di trasporto e di trasformazione.
Delle 18 Aflatossine note, le più frequenti ritrovate come contaminanti naturali sono: la B1, B2, G1, G2, M1, M2.
Le prime quattro si trovano specie nei prodotti di origine vegetale, le M1 e M2 invece si rinvengono nella carne e nel latte.
La Aflatossina M1 é un sottoprodotto del metabolismo epatico di detossificazione dell'Aflatossina Bl ottenuto mediante una reazione di idrossilazione che conduce ad una molecola più polare e meglio trasportabile attraverso il circolo sanguigno. Il discorso é del tutto analogo per la Aflatossina M2 che proviene dalla detossificazione della Aflatossina G1.
E' stato calcolato che l'ingestione dagli animali di mangimi infetti per 300 ppt provoca la produzione di 3 ng/ml di Aflatossina M1 dopo 24h.
Il tenore della Aflatossina M1 non si riduce in maniera drastica nonostante gli usuali trattamenti a cui é sottoposto il latte. Inoltre la Aflatossina M1 é stata ritrovata anche dopo 8 mesi di conservazione del latte per congelamento.
| Campione | Aflatossina Ml |
| Latte crudo | 1,57 ppt |
| Latte pastorizzato | 1,58 ppt |
| Latte sterilizzato | 1,50 ppt |
| Yogurth | 1,73 ppt |
| Siero | 0,93 ppt |

[fattore di conversione in prodotti di origine animale]
La detossificazione delle Aflatossine può altresì avvenire per coniugazione delle stesse con acido o solfato glucuronico ed eliminazione attraverso le feci.
La notevole attività tossica correlata alle Aflatossine è da imputare alla funzione epossidica presente nella molecola che conferisce alle Aflatossine proprietà mutageniche e carcinogeniche.
La Aflatossina B1 è la più tossica delle Aflatossine ed agisce come un potente agente carcinogenico e mutagenico avente come organo bersaglio il fegato.
In alcune aree geografiche del Sud Africa e del Sud-Est asiatico, l'elevato livello di contaminazione degli alimenti da Aflatossina B1 é stato correlato alla elevata incidenza epidemiologica di epatocarcinomi e di cirrosi epatiche (Coulombe, 1993; Yeh, 1989).
Delle 18 Aflatossine note, quelle che con più frequenza si ritrovano nei prodotti vegetali sono B1 e B2. Nel latte delle vacche alimentate con mangimi contaminanti da Aflatossine B1 e B2 si possono ritrovare le Aflatossine M1 e M2.
L'entità di tale "carry over", che è in funzione anche della razza bovina, varia da 0,17 al 3% (mediamente 0,33%) dell'Aflatossina B1 ingerita (Rodricks et al., 1977).
Le Aflatossine possono formarsi sia nelle piante infette (arachidi, mais, cotone, pistacchio, diversi tipi di mandorle), sia nelle derrate già riposte in magazzino.
Il contenuto minimo di umidità per la crescita delle specie Aflatossigene nelle granaglie è, approssimativamente, dell'85% di umidità relativa e a 0,78 di acqua libera.
La crescita delle specie Aflatossigene avviene nell'intervallo termico 6-46°C, mentre per la sintesi delle Aflatossine sono richieste temperature comprese tra 8 e 42°C (Wyllie e Morehouse, 1977).
Le Aflatossine sono state trovate nelle più diverse derrate agrarie, nonché nei mangimi e negli alimenti del commercio.
I prodotti più soggetti a contenere Aflatossine sono mais, arachidi e derivati, semi oleaginosi, diversi tipi di noci e mandorle, soprattutto se provenienti dalle zone tropicali e subtropicali.
Tra i prodotti zootecnici, particolarmente sentita è la presenza di Aflatossina M1 nel latte (effetto carry over), mentre sembra trascurabile la loro presenza in altri prodotti zootecnici (Rodricks et al., 1977).
Le aree geografiche più a rischio sono le regioni subtropicali e tropicali perchè è in tali regioni che più verosimilmente si verifica una concomitanza favorevole dei fattori che concorrono alla sintesi delle Aflatossine, e cioè: presenza prevalente di isolati Aflatossigeni di A. flavus e di A. parasítícus, colture e condizioni agro ambientali più idonee; tecnologie di produzione, di trasformazione e di conservazione dei prodotti non sufficientemente adeguate.
Le Aflatossine sono metaboliti con elevata tossicità acuta, dotati anche, grazie alla funzione epossidica presente nella molecola, di attività cancerogena, mutagena e teratogena.
Il loro ampio spettro di azione scaturisce dalla peculiare capacità di reagire con gli acidi nucleici e le nucleoproteine cellulari, determinando effetti deleteri sulla sintesi proteica e sull'integrità cellulare.
Le Aflatossine sono essenzialmente delle potenti epatotossine, agenti di epatocarcinomi (Eaton e Groopman, 1994).
Tra le micotossicosi naturali causate dalle Aflatossine vi è in particolare l'Aflatossicosi classica (Malattia X del Tacchino) che, anche se con diversa intensità, colpisce tutte le specie in produzione zootecnica e in particolare le specie aviarie e i suini.
Le intossicazioni di tipo acuto su manifestano con fenomeni di carcinogenesi, mutagenesi, teratogenesi, necrosi degli epatociti, alterazione della coagulazione e fragilità capillare.
Possono essere presenti apatia, anoressia, ipertermia, ascite, ittero e diarrea emorragica. Il fegato si può presenta con colangioectasie, carenze di glicogeno cellulare, degenerazione grassa, proliferazione fibroblastica, edema perivascolare e necrosi emorragiche.
Nelle intossicazioni croniche si osservano solo sintomi di carattere generale: Riduzione delle produzioni, ridotto ingestione dell'alimento, pelo ruvido e opaco, diarrea, calo della resa alla macekllazione e diminuzione della qualità dei prodotti.
L'aflatossina B1 è la più tossica delle aflatossine ed agisce come un potente agente carcinogenico e mutagenico avente come organo bersaglio il fegato.
In alcune aree geografiche del Sud Africa e del Sud-Est Asiatico, l'elevato livello di contaminazione degli alimenti da aflatossina B1 è stato correlato all'elevata incidenza epidemiologica di epatocarcinomi e di cirrosi epatica. Danni di tipo acuto dovuti alle aflatossine quali emorragie, dovute a fragilità capillare, necrosi degli epatociti sono evidenti dopo appena 3-6 ore dall'ingestione.
Le aflatossine sono oncogene ed immuno-soppressive e riducono sensibilmente le difese immunitarie del nostro organismo alterando il metabolismo degli interferoni coinvolti nelle risposte immunitarie e nelle reazioni antinfiammatorie.
Si è osservato che nei consumatori di stupefacenti, marjiuana ed eroina, ottenuti da piante che veicolano aflatossine, l'infezione da virus epatite B ed HIV è più aggressiva.
Nel 20% dei casi di eroinomani esaminati in Olanda ed Inghilterra vi è la positività sierica per l'aflatossina B1, aflatossina B2 e aflatossicolo.

[aflatossine M1 in Italia: SCOOP EU, 1995]

[Aflatossine M1 in Italia: SCOOP EU, 1995]

[livelli di AFL M1 in campioni di latte di produzione nazionale (ng/L)]

[livelli di AFL M1 in campioni di formaggio nazionale (ng/Kg)]

[AFL M1 in Umbria (Dati IZSUM)]

[AFL M1 in Umbria (Dati IZSUM)]

[Aflatossine in Italia: 1995-1996 (ISS)]

[aflatossine in Italia: 1995-1996 (ISS)]

[aflatossine nell'uomo (Yourtee and Kirk-Yourtee, 1989)]

[Reg. CE 1525/98 16 luglio 1998]

[CIRCOLARE 09/06/99 N. 10]
2) Ocratossina
Le Ocratossine sono prodotte da diverse specie di Aspergillus e di Penicillium, e in particolare da A. ochraccus e da P. viridicatum.
Si tratta di muffe saprofite, ubiquitarie, agenti di ammuffimento di granaglie, mangimi e alimenti.
Per la crescita dei funghi produttori di Ocratossine nei cereali, sono necessari un contenuto minimo di umidità del 15-16% e temperature di 4-37° C.
Le temperature più elevate favoriscono l'attività di A. ochraceus (12-37° C), che è anche più diffuso nelle regioni temperate, mentre le temperature più basse sono favorevoli a P. viridicatum (4-31° C) che invece è più diffuso nelle regioni fredde (Pitt e Hocking, 1985).
Nei mangimi, la presenza di Ocratossina A è molto preoccupante, come indicano i risultati delle ricerche condotte in Canada (19,7% di campioni contaminati fino a 27 ppm) e in Iugoslavia (3,7% di campioni contaminati fino a 5,13 ppm).
Tra i prodotti che con più frequenza vengono trovati contaminati da Ocratossine vi sono: cereali (orzo, mais, sorgo), arachidi, fagioli, legumi in generale, caffè, prodotti da forno (pane), mangimi e alimenti diversi. Tracce di Ocratossine si ritrovano anche nelle carni di maiale (sangue, reni) (Krogli, 1987).
In Danimarca è in vigore un limite di tolleranza di 25 ppb di Ocratossina A nelle carni suine fresche e conservate.
Le Ocratossine sono delle nefrotossine dotate di notevole tossicità. Delle nove Ocratossine descritte, solo l'Ocratossina A riveste importanza micotossicologica.
In qualche circostanza, in alcuni prodotti fortemente colonizzati dal fungo, è stata trovata anche l'Ocratossina B (Visconti e Bottalico, 1983).
Particolarmente sensibili sono gli animali monogastrici (suini e specie aviare), dove inducono patologie renali, mentre la maggiore resistenza degli animali poligastrici (bovini e ovini) è dovuta al fatto che l'Ocratossina viene inattivata dalla flora ruminale.
Tali patologie comportano la degenerazione dei tubuli prossimali seguita da fibrosi interstiziale e degenerazione glomerulale.
La sintomatologia è caratterizzata da maggior consumo di acqua, aumento del volume urinario ed uremia ed il quadro anatomo-patologico da reni pallidi e ipertrofici con evidente fibrosi corticale.
A dosi di 200 ppb, si osservano solo sintomi generali con diarrea, anoressia e disidratazione, mentre a 1 ppm, polidipsia, poliuria, diminuzione dell'incremento ponderale e aumento dell'indice di conversione. Nelle forme protratte invece si ha ulcera gastrica e gravi alterazione dello sviluppo.
Si ritiene comunque che siano necessarie concentrazioni di 1-4 ppm di Ocratossina A nella dieta per causare nei suini manifestazioni identiche a quelle osservate nelle Ocratossicosi naturali.
Inoltre, livelli di Ocratossina A di 0,3-1 ppm nella dieta di specie aviarie sarebbero sufficienti per causare la comparsa di lesioni renali.
Nei bovini, l'intossicazione da Ocratossina è rara; a dosi di 0,05 mg/Kg di peso ponderale ingerite continuamente per 4 settimane, si osserva poliuria, abbattimento, diminuzione dell'incremento ponderale, disidradatazione, riduzione del peso specifico delle urine e talvolta una lieve enterite, e da un punto di vista anatomo-patologico, reni di color grigio, consistenza fibrosa con aspetto ondulato in superficie, necrosi dei tubuli prossimali e fibrosi interstiziale.
Tra le altre manifestazioni tossiche indotte dall'Ocratossina A vi sono anche: enteriti a carico di suini e cani, aborto nei bovini, decremento della deposizione di uova nelle galline, disfunzioni del sistema immunitario in specie aviarie, effetti teratogenici su embrioni di topo, ratto, scimmia e gallina (16, 23).
In effetti, l'Ocratossina A si ritrova con frequenza, anche in elevate concentrazioni, nel sangue e nella carne di maiali colpiti da Ocratossicosi cronica.
A questo riguardo, in Danimarca è in vigore un limite di tolleranza di 25 ppb di Ocratossina A, nelle carni di maiale fresche e conservate (Van Egmond, 1987).
Le Ocratossine oltre ad essere responsabili della comparsa negli allevamenti della Ocratossicosi classica (Nefropatia micotossica dei suini e delle specie aviare), sembrano anche coinvolte in una Nefropatia micotossica dell'uomo (Nefropatia balcanica endemica dell'uomo) (Marasas e Nelson, 1987; Castegnaro et al., 1991) che si manifesta nel 3-8% della popolazione balcanica femminile rurale compresa tra i 30 e i 50 anni (Krogh, 1974).
Inoltre, l'Ocratossina A è una micotossina di tipo fetotossica ed immunosoppressiva e sono ben note le sue attività teratogeniche e carcinogeniche.
L'ingestione di 0,1 mg di Ocratossina per kg al giorno provoca danni al sistema immunitario con diminuzione delle lgG e delle lgM e modifica dell'attività del complemento.
In particolare vengono a ridursi le attività fagocitarie, la mobilità dei macrofagi, la sintesi della interleuchina-2 e le naturali attività "killer" delle cellule per cui sono spiegate alcune patologie tumorali correlate alla presenza della Ocratossina.
Numerosi sono i paesi coinvolti nelle Ocratossicosi; ad esempio in Giappone il 95% dei nefropatici risulta positivo per i livelli serici di Ocratossina (90 ng/ml) mentre in Algeria, i livelli di Ocratossina sono più simili a quelli europei di 0,1 ng/ml (Breaholtz, 1991; Creppy, 1993).

[ocratossina A in Italia: SCOOP EU, 1995]

[OCR in fluidi biologici umani]

[livelli di OCR in siero di soggetti nefropatici prima e dopo trattamento di dialisi]

[studio EC (Danimarca) per TDI OCR A - Non convalidato]
3) Zearalenone
Gli zearalenoni sono micotossine prodotte da almeno 8 diverse specie tossigene del genere Fusarium, in particolare da F. graminearum, da F. culmorum, e da F. equiseti, diffusi colonizzatori di cereali dove trovano le condizioni ottimali per la sintesi delle micotossine.
Il composto che tra i 12 metaboliti finora caratterizzati riveste la maggiore importanza micotossicologica è lo Zearalenone o gli Zearalenoli (isomeri alfa e beta), che a volte si ritrova assieme allo Zearalenolo.
Gli isolati fitopatogeni possono iniziare la loro attività tossigena nelle colture cerealicole infette (Mais, Frumento, Sorgo, Orzo, Avena) e continuarla durante la raccolta e nei prodotti conservati (granaglie, insilati, fieni) se le condizioni restano favorevoli (contenuto di umidità dei prodotti del 20-22% e alternanza di temperature diurne di 22-25° C e notturne di 12-15° C che stimolano la formazione di Zearalenone).
I prodotti soggetti a contenere Zearalenone sono essenzialmente i cereali (cariossidi, sfarinati, mangimi, alimenti) ed in modo particolare il mais. Anche in Italia, è possibile trovare Zearalenone non solo nelle spighe di mais infette, ma anche negli insilati (silomais) (Bottalico et al., 1989).
Elevate concentrazioni di Zearalenone sono piuttosto frequenti soprattutto nei mangimi e tali livelli di contaminazione giustificherebbero ampiamente i numerosi casi di iperestrismo ricorrenti negli allevamenti di suini (Richard e Thurston, 1986).
Negli animali, gli Zearalenoni non sono dotati di tossicità acuta e, piuttosto che come micotossine, andrebbero meglio considerati come sostanze ormonali dotate di attività anabolica e uterotrofica. Ma con l'aumentare della concentrazione essi determinano uno sconvolgimento delle attività ormonali legate alla riproduzione, che porta a ipofertilità e iperestrismo (Sindrome estrogenica) (Marasas e Nelson, 1987).
Da un punto di vista sintomatologico, la sindrome estrogenica è caratterizzata da scoli vaginali, iperestrogenismo, estro prolungato, anestro, modificazione libido, infertilità, pseudo-gravidanze, sviluppo ghiandola mammaria, lattazioni anormali.
Casi di ipofertilità dei suini e dei bovini sono stati segnalati già a partire da concentrazioni di Zearalenone nella razione alimentare di 10 ppb, mentre per la comparsa dei primi sintomi di iperestrismo nelle scrofette, sarebbero necessarie concentrazioni di tossina nella dieta non inferiori a 1-5 ppm. Non sembra, comunque, che gli Zearalenoni possano provocare l'aborto o la morte dei soggetti colpiti, almeno non direttamente.
Nei suini, la sintomatologia è caratterizzata da edema vulvare e delle mammella con lesioni crostose essudative e necrotiche capezzoli, prolasso vaginale e/o uterino e rettale, inibizione della secrezione di FSH e maturazione dei follicoli durante la fase preovulatoria, aborti, riduzione della natalità, ipotrofia ovarica, anestro, suinetti sotto dimensionati.
Dati più recenti indicherebbero un'attività carcinogenica di questa tossina, nonché una sua trasmissione nel latte che provocherebbe la sindrome nei suinetti. Nel verro, si possono osservare una inibizione della spermatogenesi ed una ipotrofia testicolare.
Nei bovini, a dosaggi relativamente bassi, lo Zearalenone provoca estri prolungati, diminuzione degli indici di concepimento e di non ritorni. Si possono osservare casi di vaginiti, calori prolungati, riduzione dell'assunzione degli alimenti e decremento della produzione lattea. Dosi di 1,6 mg causano anestro, irregolarità ciclo, ninfomania, scoli vaginali opachi di color grigio.
Va ricordato che lo Zearalenone è spesso associato al Deossinevalenone che ne potenzia l'azione.
Nell'uomo, gli zearalenoni non sono considerate sostanze teratogene ma rappresentano certamente delle genotossine. Il loro meccanismo d'azione è sempre di tipo ormone-simile; alterano in maniera sensibile il ciclo riproduttivo con fenomeni di ipofertilità ed iperestrismo (Sindrome estrogenica). Il loro bersaglio è rappresentato dai recettori proteici citosolici degli ormoni estrogenici.
Si osservano, inoltre, delle pseudo-gravidanze e diminuzione della libido. Sono stati accertati, nella zona di Porto Rico, numerosi casi di pubertà precoce causati da una costante somministrazione attraverso alimenti contaminati con Zearalenone a bassi livelli.
E' stata accertata, infine, la correlazione tra la presenza degli zearalenoni e l'elevata incidenza di cancro cervicale.
Le indagini condotte in Canada nel periodo 1978-80 sul mais destinato all'alimentazione umana hanno indicato la presenza di Zearalenone sia nel prodotto nazionale (in 23 di 81 campioni, in concentrazioni da 13 a 475 ppb) che nel prodotto importato (1 campione su 61, in concentrazione di 200 ppb).
La FAO ha stabilito, per la Francia, paese particolarmente colpito dagli zearalenoni, limiti di tolleranza nei cereali e negli olii vegetali di 200 ppb.
In Austria, invece, i tenori massimi consentiti nel grano duro sono di 60 ppb.

[zearalenone in alimenti da aziende bovine problema - 1994 in Austria]

[ingestione di micotossine in aziende bovine con problemi di fertilità: Nord-Italia, 1998]
4) Fumonisina
Le fumonisine sono un gruppo di micotossine scoperte nel 1986; finora ne sono state isolate sei.
La fumonisina 1, la fumonisina 2 e la fumonisina 3 sono le principali, soprattutto perché vengono prodotte in grosse quantità dal Fusarium monoliforme che ha come pianta ospite privilegiata per l'accrescimento il mais.
Strutturalmente esse sono dei diesteri di acidi tricarbossilici contenenti anche un gruppo ammino disponibile; queste caratteristiche le rendono molto simili alle sfingosine presenti come lipidi cerebrali.
Il loro meccanismo d'azione coinvolge l'inibizione della sfinganina-N-aciltrasferasi e della sfingosina-N-aciltrasferasi. L'ingestione e l'accumulo delle fumonisine è stato associato a patologie molto gravi negli animali, come la leucoencefalomalacia nei cavalli, una malattia neurotossica che comporta paralisi, edema cerebrale ed idrotorace. Le fumonisine sono inoltre causa di edema polmonare nei suini e dell'epatocarcinoma nei ratti.
La tossicità di queste micotossine è nettamente inferiore nella specie aviare in cui sono stati osservati diarrea, diminuzione del incremento ponderale, epatomegalia, scarse prestazioni ed immunosoppressione (Marijanovic et al., 1991; WHO, 2001) con dosi particolarmente elevate comprese tra 75 e 644 mg/kg.
A concentrazioni tra 10 e 30 mg/kg sono stati osservati sperimentalmente nel pollo episodi tossici associati solo ad alterazioni ematologiche (Espada et al., 1994).
La presenza delle fumonisine nel mais è stata associata all'elevata incidenza di tumori esofagei nell'uomo, in alcune zone del Sud Africa, della Cina e del Nord-Est Italia. Il Friuli è una delle zone geografiche a più elevata incidenza in Europa di tumori all'esofago, probabilmente per l'elevato consumo di mais sotto forma di polenta.
La FAO ha stabilito per la Svizzera un limite di 1000 ng/g nei prodotti a base di mais, come somma delle fumonisine 1 e 2.
5) Tricoteceni (Deossinivalenolo)
All'interno della famiglia dei tricoteceni, si ascrivono più di 100 composti strutturalmente correlati, prodotte da specie appartenenti al genere Fusarium.
I tricoteceni sono tutti altamente tossici a livelli subcellulare, cellulare e degli organi; strutturalmente sono dei composti contenenti funzioni idrossiliche OH, polari e solubili in solventi organici polari. Queste caratteristiche dei tricoteceni giustificano la loro facilità di penetrazione attraverso le membrane lipidiche e le loro interazioni con DNA, RNA ed organuli subcellulari.
Il loro meccanismo d'azione si basa sull'inibizione della sintesi proteica che può avvenire o nella fase di iniziazione o in quella di elongazione-terminazione. I tricoteceni possono interferire con i processi di sintesi proteica perché interagiscono con la subunità 60s dei ribosomi eucariotici.
Dei tricoteceni, quattro sono rinvenuti frequentemente negli alimenti: tossina T-2, vomitossina o deossinivalenolo, diacetossi scirpenolo e nivalenolo.
La tossina T-2 prodotta da Fusarium sprotricoides e da F. poae fu isolata in America da una partita di mais infetto (2 mg/Kg) e ritenuta responsabile della morte di 7 vacche da latte in un allevamento di 35 capi nel Wisconsin.
I tricoteceni possono indurre, negli animali, numerosi effetti tra cui dermatiti, leucopenia, emorragie, vomito, disturbi nervosi.
Il Deossinivalenolo, che in ragione dei suoi effetti sul bestiame (inappetenza e scarsa ritenzione del cibo) è conosciuto anche come Vomitossina, si presenta come una tra le più recenti micotossine isolate nelle farine, insilati, granaglie in generale.
Il primo episodio ampiamente documentato, risale al 1994-95 nel Maryland ove questa micotossina è stata isolata e riconosciuta nel mais dolce destinato all'alimentazione umana, durante le fasi di confezionamento.
Successivi episodi di carcinoma esofageo in Asia, in Africa ed in altre parti del mondo hanno stimolato gli studi sul Deossinivalenolo (DON) dimostrandone ampiamente la stretta correlazione tra quella patologia e la presenza di questa tossina.
I primi risultati di tali ricerche, per altro in grande fermento, hanno messo in evidenza la larga diffusione di DON che presenta livelli di concentrazione pari a 92 mg/kg.
Come sopra detto, gli effetti più evidenti sul bestiame ed in particolare nei suini, sono: inappetenza e scarsa ritenzione del cibo; per altro, segnatamente per i suini, l'uso di mais ammuffito nell'alimentazione può provocare, intossicazioni alimentari.
Attualmente si stanno migliorando le conoscenze di questa tossina correlandone la presenza nei grani, ai processi di lavorazione e trasformazione (inquinamento ambientale) nonché al clima.
Clinicamente l'intossicazione è caratterizzata in generale da vomito (stimolazione recettore medulla oblongata), irritazioni cutanee particolarmente evidenti nel suino, lesioni emorragiche, modificazione patologiche degli organi emopoietici, depressione immunitaria.
Nel suino, in particolare, si possono osservare: rifiuto dell'alimento (imputabile alla modifica sapore), più raramente vomito, perdita di peso corporeo, diarrea dei lattonzoli. Difronte al rifiuto dell'alimento, capita che gli allevatori aggiungano aromatizzanti; in tal caso, se l'alimento consumato contiene anche lo Zearalenone (ed è piuttosto frequente), esso diventa responsabile di problemi alla sfera riproduttiva, anche perché la vomitossina, se presente anche a dosi subcliniche senza effetti tossicologici evidenti, potenzia l'azione dello zearalenone.
Nel bovino, la vomitossina crea normalmente pochi problemi.
Si possono osservare di rado sintomi generici come diarrea aspecifica, ridotta assunzione dell'alimento, pelo ruvido e/o opaco, depressione sensorio e ridotta resa alla macellazione.
Nell'uomo, la vomitossina è un contaminante soprattutto di cariossidi di riso e di frumento nonché di prodotti di seconda trasformazione quali i fiocchi di avena e di riso, destinati all'alimentazione dei bambini.
La leucopenia tossica alimentare è una micotossicosi che ha colpito più volte le popolazioni della Russia Orientale, comportando una progressiva riduzione dei leucociti nel sangue.
E' stata ormai accertata l'interdipendenza tra questa malattia e il consumo di cereali ammuffiti in cui sono stati isolati insieme ai tricoteceni, altre micotossine prodotte da specie del genere Fusarium, in particolare F. tricinctum, F. graminarum e F. nivale.
Sembra addirittura che il DON possa giocare un ruolo importante nella comparsa di leucemia.
In Austria, sono stati stabiliti limiti massimi per la vomitossina, in alcuni cereali quali frumento e riso destinati all'alimentazione umana, di 500 ppb.

[vomitossina in alimenti da aziende bovine problema - 1994 in Austria]
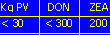
[livello massimo raccomandabile di micotossine nei mangimi per suini (ppb)]

[livello massimo raccomandabile di micotossine per cavalli adulti non riproduttori]

[livello massimo raccomandabile di micotossine in bovini]
fine 1° parte
La Seconda Parte del lavoro sulle "Micotossine degli alimenti e micotossicosi animali ed umana" verrà pubblicato su SPV di aprile.
Anche la bibliografia del lavoro sarà pubblicata nel prossimo numero.

